题目内容
【题目】下列实验现象描述不正确的是()
A.硫在空气中燃烧产生淡蓝色火焰
B.木炭在氧气中剧烈燃烧,生成二氧化碳
C.红磷在空气中燃烧产生大量白烟
D.电解水一段时间后,正负极产生气体的体积比约为1:2
【答案】B
【解析】
A、硫在空气中燃烧产生微弱的淡蓝色火焰,放出热量,产生刺激性气味,故A正确;
B、木炭在氧气中剧烈燃烧,生成二氧化碳是实验结论不是实验现象,故B错误;
C、红磷在空气中燃烧产生大量白烟,放出热量,故C正确;
D、电解水一段时间后,正、负极产生气体的体积比约为1:2,故D正确。故选B。

【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】为保证实验准确性,实验所用金属片均用砂纸打磨,打磨目的主要是:。
实验⑴为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为。
从实验现象可判断:金属活动性ZnFe(填“<”、“=”或“>”)。
【得出结论1】
金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是。
(2)实验⑵为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是。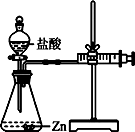
所用药品、实验数据如下表:
实验 | 选用金属 | 盐酸质量分数 | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2 | 2﹣3 | 3﹣4 | 4﹣5 | 前5分 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论2】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是。
(3)【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快原因:再由快到慢的原因是。
(4)【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?
因素1:。
因素2:。