题目内容
下列基本实验操作正确的是( )
A.  读取液体体积 B.
读取液体体积 B.  倾倒液体
倾倒液体
C.  稀释浓硫酸 D.
稀释浓硫酸 D.  点燃酒精灯
点燃酒精灯
实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
[定性探究]
(1)称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含_____。
(2)取(1)中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
①向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有_____ |
②取①中上层清液,滴加_____ | _____ | 原固体中不含NaOH |
其中,步骤①加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____。
(3)再取(1)中得到的滤液少量,进行如图1所示操作:

同学们认为:原固体中一定含有NaCl.但是老师指出这个结论不正确,其理由是_____(填序号)。
A 滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B 滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
[定量探究]
(4)在老师的指导下同学们又精确称量了10g原固体,进行如图2实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_____;其中,操作X的名称是_____,无色滤液中一定含有的阳离子是_____。根据生成沉淀的质量计算原固体中氯化钙的质量分数是_____。
利用传感器对二氧化碳性质再探究。
某兴趣小组利用传感器二氧化碳性质再探究.实验步骤如下:
步骤1:如图1所示装置的气密性良好,三瓶:250mL的烧瓶内收集满CO2气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、40%的氢氧化钠溶液).连接好装置和压强传感器.
步骤2:三位同学同时迅速将注射器内等体积的液体(水、饱和石灰水、40%的氢氧化钠溶液)注入各自烧瓶中,关闭活塞.
步骤3:一段时间后,同时振荡烧瓶.观察传感器定量实时地传回烧瓶内气压变化形成的图情况如图2所示.试回答下列问题:
(查阅资料)
资料1:Na2CO3+CO2+H2O==2NaHCO3
资料2:NaOH+NaHCO3==Na2CO3+H2O
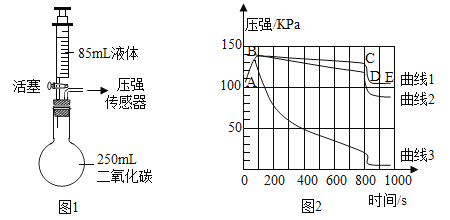
(1)图1所示实验中,用“注射器”而不用“长颈漏斗”的原因是_______________________。
(2)曲线AB段气压变化的原因是______________________。
(3)导致曲线1中________段气压变化是由于充分振荡烧瓶导致的。在不改变装置药品的情况下,进一步降低E点的方法___________________。A与E几乎在一条直线上的原因是_____________________。
(4)曲线2所代表的实验中发生的反应方程式为____________________。
(5)曲线2与曲线3差异较大的原因是_____________。
(6)探究曲线3所代表的实验后的溶液中溶质的成分:
①小明同学猜想有以下六种可能:
猜想 | 一 | 二 | 三 | 四 | 五 | 六 |
成分 | Na2CO3 | NaHCO3 | Na2CO3、NaHCO3 | Na2CO3、NaOH | NaHCO3、NaOH | Na2CO3、NaHCO3和NaOH |
小新同学认为猜想五和六都是错误的,理由是___________________________。小美同学又通过计算否定了猜想二和猜想三。
②小芳同学通过实验继续探究实验
实验步骤 | 实验现象 | 实验结论 | |
取少量该实验后的溶液于试管中,滴入酚酞溶液 | 溶液呈红色 | 溶液呈________性 | 猜想四正确 |
加入________ 溶液 | _______ | 反应的化学方程式_______ |


 _________ ________________
_________ ________________