题目内容
今有镁、锌、铜三种金属的粉末状混合物15.0克,跟足量的盐酸反应,将反应后混合液过滤,滤纸上残留物经洗涤、干燥后称其质量为3克,反应放出的气体能使31.8克氧化铜全部还原为铜(铜的相对原子质量为63.5).
试问:(1)放出气体的质量是多少克?
(2)原混合物中镁和锌的质量各是多少克?
解:设还原31.8g的氧化铜需要氢气的质量为x,
CuO+H2 Cu+H2O
Cu+H2O
79.5 2
31.8 x
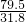 =
=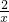
x=0.8g
滤纸上残留物经洗涤、干燥后称其质量为3克,所以铜就是3g,镁和锌的混合物是12克,
设镁质量是y,生成氢气的质量是z,锌的质量就是(12-y),生成氢气的质量为m,
Mg+2HCl=MgCl2+H2↑
24 2
y z
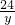 =
=
z=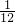 y,
y,
Zn+2HCl=ZnCl2+H2↑
65 2
12-y m
 =
=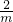
m= (12-y)
(12-y)
所以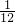 y+
y+ (12-y)=0.8
(12-y)=0.8
y=8.2g,
12-8.2=2.8g,
答:(1)放出气体的质量是0.8克,
(2)原混合物中镁和锌的质量各是8.2克和2.8克.
分析:根据氧化铜的质量,利用氢气还原氧化铜的方程式求出氢气的质量,铜不会与酸反应生成氢气,再结合氢气质量和金属的质量列出方程求解金属质量.
点评:在解此类题时,首先分析题中的反应原理,然后根据题中的数据列出关系式进行分析解答.
CuO+H2
 Cu+H2O
Cu+H2O79.5 2
31.8 x
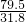 =
=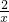
x=0.8g
滤纸上残留物经洗涤、干燥后称其质量为3克,所以铜就是3g,镁和锌的混合物是12克,
设镁质量是y,生成氢气的质量是z,锌的质量就是(12-y),生成氢气的质量为m,
Mg+2HCl=MgCl2+H2↑
24 2
y z
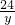 =
=
z=
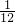 y,
y,Zn+2HCl=ZnCl2+H2↑
65 2
12-y m
 =
=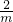
m=
 (12-y)
(12-y)所以
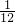 y+
y+ (12-y)=0.8
(12-y)=0.8y=8.2g,
12-8.2=2.8g,
答:(1)放出气体的质量是0.8克,
(2)原混合物中镁和锌的质量各是8.2克和2.8克.
分析:根据氧化铜的质量,利用氢气还原氧化铜的方程式求出氢气的质量,铜不会与酸反应生成氢气,再结合氢气质量和金属的质量列出方程求解金属质量.
点评:在解此类题时,首先分析题中的反应原理,然后根据题中的数据列出关系式进行分析解答.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
