题目内容
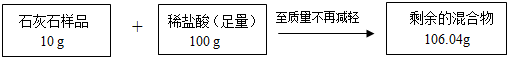
 现有失去标签的5种无色溶液,分别是Na2CO3、NaCl、Ca(OH)2、NaOH和稀盐酸,任取其中的4种贴上A、B、C、D标签,进行如图实验.
现有失去标签的5种无色溶液,分别是Na2CO3、NaCl、Ca(OH)2、NaOH和稀盐酸,任取其中的4种贴上A、B、C、D标签,进行如图实验. (1)依据如图装置进行实验,其中夹持固定装置已略 去.从长颈漏斗加入稀盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化.则C溶液与稀盐酸反应的化学方程式为
A溶液中发生反应的化学方程式为
(2)取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.则B是
考点:酸、碱、盐的鉴别,书写化学方程式、文字表达式、电离方程式
专题:物质的鉴别题
分析:根据碳酸钠和盐酸会生成二氧化碳气体,碳酸钠和氢氧化钙会生成白色的碳酸钙沉淀,氢氧化钙、氢氧化钠和盐酸会发生中和反应,没有明显现象,二氧化碳会与氢氧化钙溶液生成白色的碳酸钙沉淀,二氧化碳和氢氧化钠溶液反应没有明显现象等知识进行分析.
解答:解:碳酸钠和盐酸会生成二氧化碳气体,碳酸钠和氢氧化钙会生成白色的碳酸钙沉淀,氢氧化钙、氢氧化钠和盐酸会发生中和反应,没有明显现象,二氧化碳会与氢氧化钙溶液生成白色的碳酸钙沉淀,二氧化碳和氢氧化钠溶液反应没有明显现象.
(1)从长颈漏斗中加入盐酸,C中产生气泡,说明C中盛有的是碳酸钠溶液,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,产生的二氧化碳导入A中产生白色沉淀,说明A中盛有的是氢氧化钙溶液,二氧化碳能与氢氧化钙反应生成白色的碳酸钙沉淀和水,所以C溶液与稀盐酸反应的化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,A溶液中发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(2)盐酸是氯化氢的水溶液,气体的溶解度随温度的升高而减小,当加热B中溶液会闻到刺激性气味,说明溶解在水中的氯化氢由于温度升高而逸出,所以B是稀盐酸,再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,所以D是NaCl溶液.
故答案为:(1)Na2CO3+2HCl═2NaCl+CO2↑+H2O,CO2+Ca(OH)2═CaCO3↓+H2O;
(2)稀盐酸,NaCl溶液.
(1)从长颈漏斗中加入盐酸,C中产生气泡,说明C中盛有的是碳酸钠溶液,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,产生的二氧化碳导入A中产生白色沉淀,说明A中盛有的是氢氧化钙溶液,二氧化碳能与氢氧化钙反应生成白色的碳酸钙沉淀和水,所以C溶液与稀盐酸反应的化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,A溶液中发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(2)盐酸是氯化氢的水溶液,气体的溶解度随温度的升高而减小,当加热B中溶液会闻到刺激性气味,说明溶解在水中的氯化氢由于温度升高而逸出,所以B是稀盐酸,再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,所以D是NaCl溶液.
故答案为:(1)Na2CO3+2HCl═2NaCl+CO2↑+H2O,CO2+Ca(OH)2═CaCO3↓+H2O;
(2)稀盐酸,NaCl溶液.
点评:在解此类题时,首先分析题中所给各种物质的性质和两两之间的反应,然后结合题中各物质的现象确定具体的物质,最后进行验证即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列现象中没有发生化学变化的是( )
| A、食物在人体内被消化 |
| B、分离空气制取氧气 |
| C、将葡萄酿成酒 |
| D、米饭变馊 |
下列对宏观现象的微观解释不正确的是( )
| A、氧气加压后变成液氧,是因为分子间的间隔变小 |
| B、稀有气体可做保护气,因为原子最外层电子达到相对稳定结构 |
| C、非吸烟者受到被动吸烟的危害,是因为分子在不断地运动 |
| D、水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 |
 据报道:一颗陨石在俄罗斯中部乌拉尔山区的车里雅宾斯克市坠落,陨石进入大气层时速度达到了40倍音速,而落地前的飞行速度减小到了30公里/时.由此引发的“陨石雨”导致超过1200名当地居民受伤.
据报道:一颗陨石在俄罗斯中部乌拉尔山区的车里雅宾斯克市坠落,陨石进入大气层时速度达到了40倍音速,而落地前的飞行速度减小到了30公里/时.由此引发的“陨石雨”导致超过1200名当地居民受伤.  某化学兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.
某化学兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.