题目内容
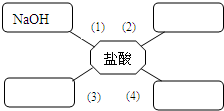
(Ⅰ)仿照(1)选择初中化学中常见的物质,填入到如图的方框中,使直线之间的物质能发生反应,且所有方框中的物质必须属于不同的物质类别.写出相应的化学方程式.
(1)NaOH+HCl=NaCl+H2O碱与酸反应
(2)______,______与酸反应.
(3)______,______与酸反应.
(4)______,______与酸反应.
(Ⅱ)有一无色溶液含有CuSO4、HCl、BaCl2、Ba(OH)2、NaOH、NaCl、Na2CO3中的某两种,做如下实验:①测得溶液的pH=14;②向溶液中加入Na2SO4有沉淀生成.沉淀的名称是______,溶液中含有的两种溶质的可能组合是:①______②______.
(1)NaOH+HCl=NaCl+H2O碱与酸反应
(2)______,______与酸反应.
(3)______,______与酸反应.
(4)______,______与酸反应.
(Ⅱ)有一无色溶液含有CuSO4、HCl、BaCl2、Ba(OH)2、NaOH、NaCl、Na2CO3中的某两种,做如下实验:①测得溶液的pH=14;②向溶液中加入Na2SO4有沉淀生成.沉淀的名称是______,溶液中含有的两种溶质的可能组合是:①______②______.

(Ⅰ)由于能够和酸发生反应的物质有五类,能书写出化学方程式的有四类:活泼金属、金属氧化物、碱、盐,题目中已经有了碱,因此可以从其他三种物质中选择合适的物质(答对即可)
(Ⅱ)根据溶液为无色溶液,可判断溶液中不含CuSO4;根据测得溶液的pH=14,溶液呈碱性,可判断溶液中一定含有Ba(OH)2、NaOH、或Na2CO3中的一种或两种,溶液中一定不含HCl;根据溶液而在可能含有BaCl2、Ba(OH)2、NaOH、NaCl、Na2CO3中只有Ba(OH)2和BaCl2能与Na2SO4生成硫酸钡沉淀,因此溶液中一定含Ba(OH)2、BaCl2中的一种或两种,而Ba(OH)2和BaCl2不能与Na2CO3在同一溶液中共存,可判断溶液为一定不含有Na2CO3;
综合以上分析,溶液可能由BaCl2、Ba(OH)2、NaOH、NaCl中的两种物质组成,故溶液的可能组成有以下四种:①Ba(OH)2、BaCl2;②Ba(OH)2、NaOH;③Ba(OH)2、NaCl;④NaOH、BaCl2;
故答案为:(Ⅰ)(6分)(化学方程式每空1.(5分),其余每空0.(5分),共6分)
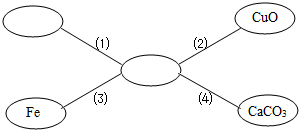
答案是开放性的,只要写出金属、金属氧化物和盐分别与盐酸反应的化学方程式,正确均给分.
(Ⅱ)(3分)硫酸钡
①Ba(OH)2BaCl2②Ba(OH)2NaOH(或Ba(OH)2NaCl;或NaOHBaCl2)
(Ⅱ)根据溶液为无色溶液,可判断溶液中不含CuSO4;根据测得溶液的pH=14,溶液呈碱性,可判断溶液中一定含有Ba(OH)2、NaOH、或Na2CO3中的一种或两种,溶液中一定不含HCl;根据溶液而在可能含有BaCl2、Ba(OH)2、NaOH、NaCl、Na2CO3中只有Ba(OH)2和BaCl2能与Na2SO4生成硫酸钡沉淀,因此溶液中一定含Ba(OH)2、BaCl2中的一种或两种,而Ba(OH)2和BaCl2不能与Na2CO3在同一溶液中共存,可判断溶液为一定不含有Na2CO3;
综合以上分析,溶液可能由BaCl2、Ba(OH)2、NaOH、NaCl中的两种物质组成,故溶液的可能组成有以下四种:①Ba(OH)2、BaCl2;②Ba(OH)2、NaOH;③Ba(OH)2、NaCl;④NaOH、BaCl2;
故答案为:(Ⅰ)(6分)(化学方程式每空1.(5分),其余每空0.(5分),共6分)

答案是开放性的,只要写出金属、金属氧化物和盐分别与盐酸反应的化学方程式,正确均给分.
(Ⅱ)(3分)硫酸钡
①Ba(OH)2BaCl2②Ba(OH)2NaOH(或Ba(OH)2NaCl;或NaOHBaCl2)

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目