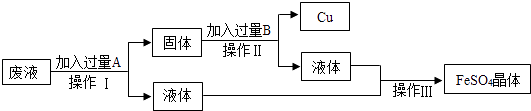
题目内容
【题目】一包白色粉末可能有CaCO3、K2SO4、CuSO4、BaCl2、K2CO3的一种或几种,现在进行如下实验.其中说法错误的是( ) 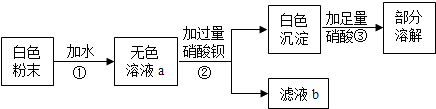
A.由操作①可知:白色粉末中一定没有CaCO3、CuSO4
B.由操作②可知:白色粉末中一定有BaCl2
C.由操作③可知:白色粉末中一定有K2SO4和K2CO3
D.滤液b中的溶质有3种
【答案】B、D
【解析】解: 因为无色溶液a,白色粉末碳酸钙为白色固体,难溶于水,故一定不含有;无色溶液加入过量的硝酸钡,生成沉淀,而加入足量硝酸而部分溶解,说明原混合物中有硫酸钾和碳酸钾,进而确定原混合物无氯化钡.因为无色溶液a,一定无硫酸铜;从而可以判断一定含有碳酸钾、硫酸钾,而一定不含有氯化钡、碳酸钙、硫酸铜.
A、由上述分析可知:操作①可知:白色粉末中一定没有CaCO3、CuSO4 , 故A正确;
B、由上述分析可知:操作②可知:此白色粉末中一定没有BaCl2 . 故B错误.
C、由上述分析可知:由操作③可知:白色粉末中一定有K2SO4和K2CO3 , 故C正确;
D、由上述分析可知:滤液b中的溶质有2种,为硝酸钾、硝酸钡.故D错误.
故选:B、D.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目