题目内容
某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有溶质质量分数为20%的废硫酸9.8 t,与足量的废铁屑起反应,可生产硫酸亚铁的质量是多少?
解:设可生产硫酸亚铁的质量为x,
Fe+H2SO4═FeSO4+H2↑
98 152
9.8t×20% x
∴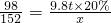
解之得:x=3.04t.
答:可生产硫酸亚铁的质量是3.04t.
分析:根据化学方程式得出各物质之间的质量比,列出比例式,即可计算出可生产硫酸亚铁的质量.
点评:本题主要考查学生运用化学方程式进行计算的能力.
Fe+H2SO4═FeSO4+H2↑
98 152
9.8t×20% x
∴
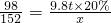
解之得:x=3.04t.
答:可生产硫酸亚铁的质量是3.04t.
分析:根据化学方程式得出各物质之间的质量比,列出比例式,即可计算出可生产硫酸亚铁的质量.
点评:本题主要考查学生运用化学方程式进行计算的能力.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目