题目内容
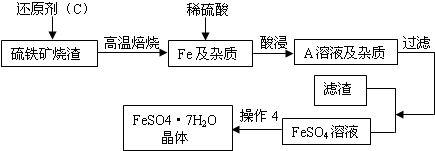
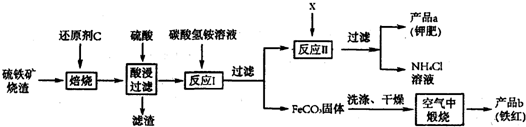
硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如图所示:
(1)硫铁矿是
(2)若焙烧时C与O2不完全燃烧产生的气体能将铁的多种氧化物还原成铁单质,试写出该气体与Fe3O4反应的化学方程式
(3)酸浸、过滤后滤液中的溶质主要是
(4)在空气中煅烧FeCO3生成Fe2O3与CO2,该反应的化学反应方程式为:
(5)若产品a的主要成分是K2SO4,得到产品a时加入的试剂X为
S(NH4Cl)[试选填“<”或“>”或“=”]:过滤后溶液仍浑浊,可能的原因是

(1)硫铁矿是
混合
混合
物(填“纯净”或“混合”).(2)若焙烧时C与O2不完全燃烧产生的气体能将铁的多种氧化物还原成铁单质,试写出该气体与Fe3O4反应的化学方程式
Fe3O4+4CO
3Fe+4CO2
| ||
Fe3O4+4CO
3Fe+4CO2
.
| ||
(3)酸浸、过滤后滤液中的溶质主要是
FeSO4
FeSO4
.(4)在空气中煅烧FeCO3生成Fe2O3与CO2,该反应的化学反应方程式为:
4FeCO3+O2
2Fe2O3+4CO2
| ||
4FeCO3+O2
2Fe2O3+4CO2
.
| ||
(5)若产品a的主要成分是K2SO4,得到产品a时加入的试剂X为
KCl
KCl
.则在此条件下溶解度S(K2SO4)<
<
S(NH4Cl)[试选填“<”或“>”或“=”]:过滤后溶液仍浑浊,可能的原因是
滤纸破损,过滤时漏斗里的液面高于滤纸边缘(或降温后有少量氯化铵晶体析出)
滤纸破损,过滤时漏斗里的液面高于滤纸边缘(或降温后有少量氯化铵晶体析出)
.分析:(1)根据硫铁矿的组成考虑;(2)根据方程式的书写考虑;(3)根据酸浸后发生的反应考虑生成物;(4)根据书写方程式的原则书写(5)根据反应流程以及过滤原理分析
解答:解:(1)根据硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)可知硫铁矿中含有很多物质,属于混合物;
(2)C与氧气不完全燃烧生成一氧化碳,一氧化碳与Fe3O4反应生成物是铁和二氧化碳,化学方程式为Fe3O4+4CO
3Fe+4CO2
(3)酸浸后发生的反应是铁与硫酸反应生成硫酸亚铁和氢气,所以酸浸、过滤后滤液中的溶质主要是硫酸亚铁
(4)在空气中煅烧FeCO3的反应物是FeCO3和氧气,生成物是Fe2O3与CO2,反应条件是高温,所以方程式是:4FeCO3+O2
2Fe2O3+4CO2.
(5)由流程图可以看出酸浸、过滤后滤液中的溶质主要是硫酸亚铁,硫酸亚铁和碳酸氢铵反应生成碳酸亚铁和硫酸铵,过滤后反应Ⅱ中硫酸铵与X反应生成硫酸钾和氯化铵,因此加入的X应为氯化钾,要过滤得到硫酸钾,说明在此条件下硫酸钾的溶解度小于氯化铵的溶解度,过滤后滤液仍然浑浊,可能是因为滤纸破损,过滤时漏斗里的液面高于滤纸边缘(或降温后有少量氯化铵晶体析出)
故答案为:(1)混合.
(2)Fe3O4+4CO
3Fe+4CO2.
(3)FeSO4.
(4)4FeCO3+O2
2Fe2O3+4CO2.
(5)KCl.<
滤纸破损,过滤时漏斗里的液面高于滤纸边缘(或降温后有少量氯化铵晶体析出)
(2)C与氧气不完全燃烧生成一氧化碳,一氧化碳与Fe3O4反应生成物是铁和二氧化碳,化学方程式为Fe3O4+4CO
| ||
(3)酸浸后发生的反应是铁与硫酸反应生成硫酸亚铁和氢气,所以酸浸、过滤后滤液中的溶质主要是硫酸亚铁
(4)在空气中煅烧FeCO3的反应物是FeCO3和氧气,生成物是Fe2O3与CO2,反应条件是高温,所以方程式是:4FeCO3+O2
| ||
(5)由流程图可以看出酸浸、过滤后滤液中的溶质主要是硫酸亚铁,硫酸亚铁和碳酸氢铵反应生成碳酸亚铁和硫酸铵,过滤后反应Ⅱ中硫酸铵与X反应生成硫酸钾和氯化铵,因此加入的X应为氯化钾,要过滤得到硫酸钾,说明在此条件下硫酸钾的溶解度小于氯化铵的溶解度,过滤后滤液仍然浑浊,可能是因为滤纸破损,过滤时漏斗里的液面高于滤纸边缘(或降温后有少量氯化铵晶体析出)
故答案为:(1)混合.
(2)Fe3O4+4CO
| ||
(3)FeSO4.
(4)4FeCO3+O2
| ||
(5)KCl.<
滤纸破损,过滤时漏斗里的液面高于滤纸边缘(或降温后有少量氯化铵晶体析出)
点评:解答本题关键是要知道方程式的书写注意事项,知道纯净物与混合物的区别是:是否由一种物质组成;

练习册系列答案
相关题目