题目内容
【题目】金属与人类的生产生活息息相关。
(1)自然界中除了陨石外难以找到单质铁,这是因为较活泼的金属元素往往以___(填“化合物”或“单质”)形式存在于自然界。
(2)我国是最早使用胆铜法炼铜的国家,其反应原理是:Fe+CuSO4=Cu+FeSO4,该反应的基本类型为___反应,该反应利用了铁的金属活动性比铜___(填“强”或“弱”)。
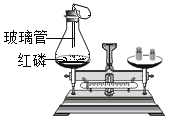
(3)为了从废弃黑色铜丝(表面有黑色氧化铜)中回收金属铜,某同学现制定甲、乙两种实验方案。
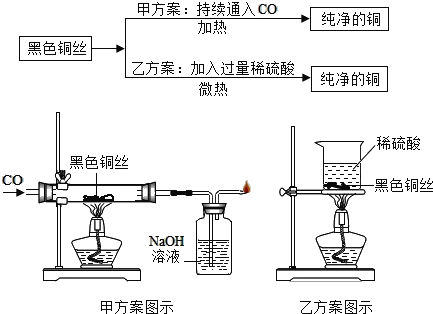
①甲方案的硬质玻璃管中可观察到的实验现象是________________,氢氧化钠溶液的作用是_________ 。
②乙方案中发生反应的化学方程式为_________ ,反应现象为_________ ,反应后的溶质为_________ 。
③理论上,方案___(填“甲”或“乙”)最终所得铜的质量较大。
【答案】化合物 置换 强 黑色的铜丝变红 吸收二氧化碳 H2SO4+CuO=CuSO4+H2O 黑色褪去,溶液由无色逐渐变成蓝色 硫酸铜、硫酸 甲
【解析】
(1)较活泼的金属比较容易与其它物质发生反应,故一般情况下以“化合物”的形式存在。故答案为:化合物。
(2)Fe+CuSO4=Cu+FeSO4这个反应符合单质与化合物反应生成新单质和新化合物的反应类型,属于置换反应。铁能把铜从硫酸铜溶液中置换出来,说明铁的活动性比铜强。故答案为:置换;强。
(3)①因为一氧化碳具有还原性,能把黑色的氧化铜还原为红色的铜。氢氧化钠能与二氧化碳发生化学反应,可以吸收二氧化碳。故答案为:黑色的铜丝变红;吸收二氧化碳。②稀硫酸能与氧化铜发生化学反应,化学方程式为H2SO4+CuO=CuSO4+H2O,因为硫酸铜溶液为蓝色,所以黑色褪去,溶液由无色逐渐变成蓝色,因为使用的稀硫酸过量,溶液中的溶质就是硫酸铜和硫酸。故答案为:H2SO4+CuO=CuSO4+H2O;黑色褪去,溶液由无色逐渐变成蓝色;硫酸铜。③甲中的一部分氧化铜被还原为铜,乙中的氧化铜全部被稀硫酸反应完。故答案为:甲。

【题目】分类、类比是学习化学常用的方法,掌握这些方法有助于学生学习化学知识。
(1)初中化学有许多实验,若按照实验主要目的可将实验分为:探究物质发生化学反应前后质量关系,探究物质的性质,探究物质的含量等。据此应将下列实验中的D与_______(填“A”或“B”或“C”)归为一类,依据是_____。
|
|
|
|
A | B | C | D |
(2)①电子数为 10 的粒子很多,其中包含电子数等于质子数的一些粒子。请将合适的化学符号填入空白HF、H2O、_____、CH4、Ne。
②查阅资料得知Mg、Mn、Fe、Cu四种金属活动性顺序是:“由强到弱”。若用实验验证这个结论,可以通过以下三个置换反应验证, 其中两个反应的化学方程式为:A.![]() 、B.
、B.![]() ,结合上述两个反应的化学方程式,请写出缺少的一个反应的化学方程式为_____。
,结合上述两个反应的化学方程式,请写出缺少的一个反应的化学方程式为_____。