题目内容
【题目】某食用纯碱中含有少量的氯化钠,为测定该纯碱中碳酸钠(Na2CO3)的含量,现取该纯碱样品12.5g,加入150.0g稀盐酸溶液恰好完全反应,测得反应后溶液总质量变成158.1g。请计算:
(1)反应中产生CO2的质量为_____g
(2)反应后所得溶液中溶质的质量分数_____(精确到0.1%)。
【答案】4.4g 8.6%
【解析】
碳酸钠和稀盐酸反应生成氯化钠和二氧化碳和水,稀盐酸和氯化钠不反应。
(1)生成二氧化碳的质量为:12.5g+150.0g-158.1g=4.4g;
(2)设纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为y
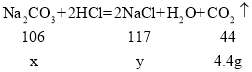
![]()
解得:x=10.6g y=11.7g。
反应后所得溶液中溶质的质量分数为:![]() ×100%≈8.6%。
×100%≈8.6%。
答:(1)生成气体的质量为4.4g;(2)反应后所得溶液中溶质的质量分数8.6%。

练习册系列答案
相关题目
【题目】下列是初中化学部分重要的实验或实验装置。请按要求填空:
|
|
|
A测定空气中氧气体积含量 | B测定二氧化碳性质 | C探究燃烧条件 |
(1)A实验如果实验数据小于1/5,可能原因是_______。(写出一点)
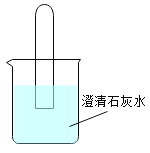
(2)将一个充满二氧化碳的试管倒立在盛有澄清石灰水的烧杯中,可以观察到的现象是_______,该反应的化学方程式为_________。
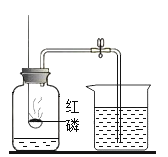
(3)通过C实验说明燃烧需要的条件为_______。