题目内容
【题目】某种氧化铜样品中混有少量木炭粉,为测定该样品中氧化铜的质量分数,某同学设计了如图装置进行实验(N2不参加反应,不考虑外界空气对实验的影响)。
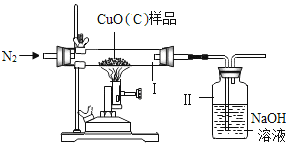
①该实验需要测定的量:反应前后装置Ⅱ的质量和______________的质量
②充分反应后,装置Ⅱ的质量增加了0.44g,求参加反应的氢氧化钠的质量_______________。(请根据化学方程式列式计算)
③实验过程中需持续缓缓通入氮气,其作用是__________________________________。
【答案】 放入Ⅰ中的样品 0.8g 把生成的CO2气体全部排入Ⅱ中,使之完全被NaOH溶液吸收
【解析】该样品中氧化铜的质量分数=氧化铜的质量÷样品的质量×100%,①该实验需要测定的量:反应前后装置Ⅱ的质量和样品的质量;②充设参加反应的氢氧化钠的质量为x
CO2 + 2NaOH![]() Na2CO3 + H2O
Na2CO3 + H2O
44 80
0.44 x![]() x=0.8g
x=0.8g
③实验过程中需持续缓缓通入氮气,其作用是把生成的CO2气体全部排入Ⅱ中,使之完全被NaOH溶液吸收。

练习册系列答案
相关题目