题目内容
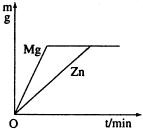
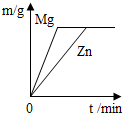 把一定质量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成氢气的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌和镁的质量比是( )
把一定质量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成氢气的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌和镁的质量比是( )| A、1:1 | B、24:65 | C、65:24 | D、无法确定 |
分析:利用一定金属与酸充分反应放出氢气的质量=
×金属的质量计算产生等质量的氢气时消耗金属镁与锌的质量比.
| 金属的化合价 |
| 金属的相对原子质量 |
解答:解:设投入金属镁的质量为x,金属锌的质量为y
金属镁与锌在反应中均表现出+2价,镁的相对原子质量为24、锌的相对原子质量为65
×x=
×y
解得x:y=24:65
故选C.
金属镁与锌在反应中均表现出+2价,镁的相对原子质量为24、锌的相对原子质量为65
| 2 |
| 24 |
| 2 |
| 65 |
解得x:y=24:65
故选C.
点评:利用一定金属与酸充分反应放出氢气的质量=
×金属的质量进行计算可简化化学方程式的计算.
| 金属的化合价 |
| 金属的相对原子质量 |

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目