题目内容
不纯的铁粉6克,放入盛有50克稀硫酸的烧杯中,恰好完全反应,测知烧杯中物质质量为55.8克.(杂质不溶于稀硫酸)试求:
(1)铁粉中含杂质的质量分数;
(2)稀硫酸溶液的质量分数;
(3)反应后所得溶液中溶质的质量分数(本问题结果保留整数).
(1)铁粉中含杂质的质量分数;
(2)稀硫酸溶液的质量分数;
(3)反应后所得溶液中溶质的质量分数(本问题结果保留整数).
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:反应后烧杯内物质的总质量比反应前(样品和稀硫酸)减少的质量就是生成的气体质量,根据这一数据和化学方程式即可计算出铁粉中铁的质量和反应的硫酸的质量以及生成的硫酸亚铁的质量,据此解答即可.
解答:解:由质量守恒定律可知烧杯中物质质量减少的质量即是铁与稀硫酸反应生成氢气的质量:6g+50g-55.8g=0.2g;
设铁粉中铁的质量为x,消耗的硫酸的质量是y,生成的硫酸亚铁的质量为z;
Fe+H2SO4=FeSO4+H2↑
56 98 152 2
x y z 0.2g
=
,
=
,
=
x=5.6g,y=9.8g,z=15.2g;
(1)铁粉中含杂质的质量分数为:
×100%=6.7%
(2)稀硫酸溶液的质量分数为:
×100%=19.6%
(3)反应后所得溶液中溶质的质量分数:
×100%=27.4%
答:(1)铁粉中含杂质的质量分数为6.7%.(2)稀硫酸溶液的质量分数是19.6%.(3)反应后所得溶液中溶质的质量分数27.4%.
设铁粉中铁的质量为x,消耗的硫酸的质量是y,生成的硫酸亚铁的质量为z;
Fe+H2SO4=FeSO4+H2↑
56 98 152 2
x y z 0.2g
| 56 |
| x |
| 2 |
| 0.2g |
| 98 |
| y |
| 2 |
| 0.2g |
| 152 |
| z |
| 2 |
| 0.2g |
x=5.6g,y=9.8g,z=15.2g;
(1)铁粉中含杂质的质量分数为:
| 6g-5.6g |
| 6g |
(2)稀硫酸溶液的质量分数为:
| 9.8g |
| 50g |
(3)反应后所得溶液中溶质的质量分数:
| 15.2g |
| 5.6g+50g-0.2g |
答:(1)铁粉中含杂质的质量分数为6.7%.(2)稀硫酸溶液的质量分数是19.6%.(3)反应后所得溶液中溶质的质量分数27.4%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
在实验室中,同学们用如下装置制取纯净的CO2,下列说法不正确的是( )
资料:饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2
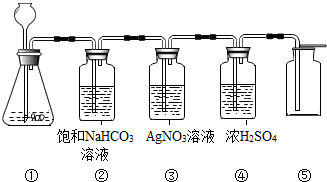
资料:饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2

| A、①中固体反应物可选择大理石和稀硫酸 |
| B、③中没有白色沉淀产生,说明CO2气体中已经不混有HCl气体 |
| C、④中浓H2SO4的作用是吸收CO2气体中混有的H2O |
| D、将燃着的小木条放在⑤中的集气瓶口,可以检验集气瓶是否收集满CO2 |