题目内容
请你和小明一起进行实验室制取二氧化碳的探究.
(1)选择药品.小明对三组药品进行了研究,实验记录如下:
从制取和收集的角度分析,一般选择第 组药品,用该组药品制取二氧化碳的化学方程式为 ;不选择第③组药品的原因是 .
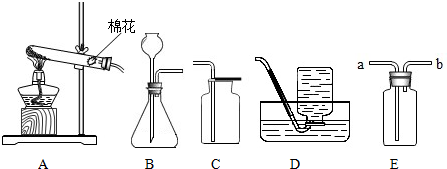
(2)选择装置.通过思考,他从如图中选择了 (填序号)发生装置来制取二氧化碳,你认为他选择的依据是 .

(3)制取气体.将药品装入所选装置制取气体,并用 装置来收集.验满方法是 .
(4)气体检验.将生成的气体通入石蕊溶液中,溶液变红,因此他确定该气体是二氧化碳,原因是(用化学方程式表示) .他的检验方法是否正确? (填“正确”或“不正确”),请说明理由: .
(5)反思、总结:你认为小明选择的装置还能用来制取并收集的气体是 ,反应的化学方程式为 ,使用该套装置制取气体时的一点注意事项是 .
(1)选择药品.小明对三组药品进行了研究,实验记录如下:
| 级别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀盐酸 | 产生气泡速率很慢并逐渐停止 |
| ③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
(2)选择装置.通过思考,他从如图中选择了

(3)制取气体.将药品装入所选装置制取气体,并用
(4)气体检验.将生成的气体通入石蕊溶液中,溶液变红,因此他确定该气体是二氧化碳,原因是(用化学方程式表示)
(5)反思、总结:你认为小明选择的装置还能用来制取并收集的气体是
考点:二氧化碳的实验室制法,二氧化碳的检验和验满,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)实验室制取气体时,反应速率太快,影响气体的收集,反应速率太慢,会导致收集的气体不纯,同时会浪费时间;
(2)实验室制取气体时,有两种常用的实验装置,一种是反应物是固体,反应需要加热,另一种是反应物是液体和固体,反应不需要加热;
(3)二氧化碳的密度比空气大,不能燃烧,不支持燃烧;
(4)二氧化碳溶于水后生成弱酸H2CO3;酸性溶液都可以使紫色石蕊试液变红;二氧化碳可以使澄清的石灰水变浑浊.根据这三方面进行填空;
(5)气体发生装置的选择取决于反应物的状态和反应的条件,收集装置的选择取决于气体的水溶性和密度,据此解答即可.
(2)实验室制取气体时,有两种常用的实验装置,一种是反应物是固体,反应需要加热,另一种是反应物是液体和固体,反应不需要加热;
(3)二氧化碳的密度比空气大,不能燃烧,不支持燃烧;
(4)二氧化碳溶于水后生成弱酸H2CO3;酸性溶液都可以使紫色石蕊试液变红;二氧化碳可以使澄清的石灰水变浑浊.根据这三方面进行填空;
(5)气体发生装置的选择取决于反应物的状态和反应的条件,收集装置的选择取决于气体的水溶性和密度,据此解答即可.
解答:解:(1)从制取和收集的角度分析,一般选择第①组药品,因为块状石灰石和稀盐酸反应时,产生气泡速率适中,便于二氧化碳的收集;
石灰石的主要成分是碳酸钙,和稀盐酸反应能生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
不选择第③组药品的原因是反应速率太快,不利于收集二氧化碳.
故填:①;CaCO3+2HCl=CaCl2+H2O+CO2↑;反应速率太快,不利于收集二氧化碳.
(2)制取二氧化碳用碳酸钙和盐酸,不需要加热,所以选择“固+液 常温型”的发生装置B.
故填:B,不需要加热.
(3)由于二氧化碳能溶于水,不能用排水法收集,密度比空气大只能用向上排空气法收集,故收集装置选择E.因为二氧化碳不燃烧,也不支持燃烧,所以验满方法是将燃着的木条放到集气瓶口,能够熄灭,说明已满;
故填:E;燃着木条伸到瓶口熄灭;
(4)二氧化碳溶于水后,生成弱酸碳酸,其反应方程式为:CO2+H2O=H2CO3.碳酸能使紫色石蕊试液变红,但是据此可以判定该气体是二氧化碳,这种说法是错误的,因为其他酸性气体通入石蕊溶液中,溶液也变红.一般情况下,根据二氧化碳能使澄清的石灰水变浑浊的特性,来检验二氧化碳的存在,其反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
故填:CO2+H2O=H2CO3;不正确,其他酸性气体通入石蕊溶液中,溶液也变红;
(5)使用过氧化氢和二氧化锰的混合物制取氧气,是“固+液 常温型”反应,选用B装置制取氧气,其反应方程式为2H2O2
2H2O+O2↑.氧气的密度比空气大能用向上排空气法收集.使用长颈漏斗时,要注意伸到液面以下,防止生成的气体逸出.
故填:氧气;2H2O2
2H2O+O2↑.长颈漏斗要伸到液面以下,防止生成的气体逸出.
石灰石的主要成分是碳酸钙,和稀盐酸反应能生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
不选择第③组药品的原因是反应速率太快,不利于收集二氧化碳.
故填:①;CaCO3+2HCl=CaCl2+H2O+CO2↑;反应速率太快,不利于收集二氧化碳.
(2)制取二氧化碳用碳酸钙和盐酸,不需要加热,所以选择“固+液 常温型”的发生装置B.
故填:B,不需要加热.
(3)由于二氧化碳能溶于水,不能用排水法收集,密度比空气大只能用向上排空气法收集,故收集装置选择E.因为二氧化碳不燃烧,也不支持燃烧,所以验满方法是将燃着的木条放到集气瓶口,能够熄灭,说明已满;
故填:E;燃着木条伸到瓶口熄灭;
(4)二氧化碳溶于水后,生成弱酸碳酸,其反应方程式为:CO2+H2O=H2CO3.碳酸能使紫色石蕊试液变红,但是据此可以判定该气体是二氧化碳,这种说法是错误的,因为其他酸性气体通入石蕊溶液中,溶液也变红.一般情况下,根据二氧化碳能使澄清的石灰水变浑浊的特性,来检验二氧化碳的存在,其反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
故填:CO2+H2O=H2CO3;不正确,其他酸性气体通入石蕊溶液中,溶液也变红;
(5)使用过氧化氢和二氧化锰的混合物制取氧气,是“固+液 常温型”反应,选用B装置制取氧气,其反应方程式为2H2O2
| ||
故填:氧气;2H2O2
| ||
点评:通过回答本题知道了对比实验的设计方法,掌握了实验室制取二氧化碳的反应原理和二氧化碳的验满方法,知道了能够控制反应速度的装置的选择方法.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
化学源于生活,同时又服务于生活.以下做法不合理的是( )
| A、用食醋除去暖水瓶中的薄层水垢 |
| B、用纯碱代替小苏打做食品发酵粉 |
| C、将农家肥料与化学肥料配合使用,以提高产量和效益 |
| D、将硝酸铵与熟石灰等碱性物质混合施用,既给农作物提供了营养元素,同时又可降低土壤的酸性 |
量取液体试剂时,某同学采用仰视读数,得到量筒内液体体积为30mL,倒出一些液体后,他又采用俯视读数,得到液体体积为20mL.则他倒出液体体积为( )
| A、10mL |
| B、无法判断 |
| C、大于10mL |
| D、小于10mL |
下列化学方程式书写正确的是( )
| A、2Fe+6HCl=2FeCl3+3H2↑ | ||||
| B、2H2O=O2↑+2H2↑ | ||||
C、CO2+C
| ||||
| D、SO2+NaOH=Na2SO3+H2O |
现有一瓶空气,要除去其中的氧气而得到较纯净的氮气,可用下列某物质在瓶中燃烧( )
| A、细铁丝 | B、蜡烛 | C、红磷 | D、木炭 |
 在学习完“二氧化碳性质”后,某班化学兴趣小组的同学想对雪碧中逸出的气体进行探究(如图是雪碧汽水配料表)
在学习完“二氧化碳性质”后,某班化学兴趣小组的同学想对雪碧中逸出的气体进行探究(如图是雪碧汽水配料表) 某实验小组用如图装置研究CO2的性质.
某实验小组用如图装置研究CO2的性质.