题目内容
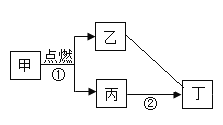
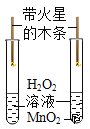
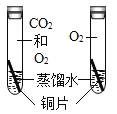
【题目】A一F和甲,乙是初中化学学习中常见的八种物质,它们之间的转化关系如图所示,其中A、B是组成元素相同的两种化合物,C、D和甲、乙都是气体。(“→”表示物质间能一步转化,部分反应物、生成物和反应条件略去)请根据初中化学所学知识解答下列问题:
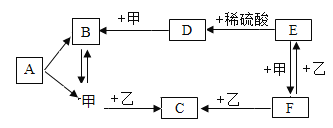
(1)写出A→甲+B的化学方程式_____。
(2)若F为黑色固体,写出E→F的化学方程式_____。
(3)写出甲→C的化学方程式_____。
(4)乙和D共同具有的化学性质有_____。
【答案】2H2O2![]() 2H2O+O2↑ 3Fe+2O2
2H2O+O2↑ 3Fe+2O2![]() Fe3O4 2CO+O2
Fe3O4 2CO+O2![]() 2CO2 可燃性和还原性
2CO2 可燃性和还原性
【解析】
A、B是组成元素相同的两种化合物,C、D和甲、乙都是气体可知,A是过氧化氢,B是水,甲是氧气;D是由E和稀硫酸反应制得的气体,可推知D是氢气,E可以是铁;铁和氧气反应生成四氧化三铁,四氧化三铁和一氧化碳反应生成铁和二氧化碳,故F是四氧化三铁,乙是一氧化碳,C是氧气和一氧化碳反应生成的二氧化碳,经验证,推到正确。
(1)A→甲+B是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;故填:2H2O2
2H2O+O2↑;故填:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)若F为黑色固体,即四氧化三铁,则 E→F是铁和氧气点燃生成四氧化三铁,反应的化学方程式为:3Fe+2O2![]() Fe3O4;故填:3Fe+2O2
Fe3O4;故填:3Fe+2O2![]() Fe3O4;
Fe3O4;
(3)甲→C是一氧化碳和氧气在点燃条件下生成二氧化碳,反应的化学方程式为:2CO+O2![]() 2CO2;故填:2CO+O2
2CO2;故填:2CO+O2![]() 2CO2;
2CO2;
(4)乙是一氧化碳,D是氢气,氢气和一氧化碳都有可燃烧和还原性,故填:可燃性和还原性。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】实验室常用下列装置研究气体的制取,根据所学知识回答下列问题。

(1)利用上图所示装置,下面不能完成实验室制取气体的是____(填字母)
A 用③⑥制取氧气
B 用①④制取氧气
C 用②④制取二氧化碳
D 用③④制取氢气
(2)用装置B作为气体发生装置对反应物状态和反应条件的要求是_____。
(3)实验室用高锰酸钾制取一瓶较纯净的氧气,收集气体结束时,为防止试管炸裂正确的操作是___;该反应的化学方程式为_____。
(4)请你和小明一起进行实验室制取二氧化碳的探究。
I选择药品。小明对三组药品进行了研究,实验记录如下:
组别 | 药品 | 实验现象 |
A | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
B | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
C | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
从制取和收集的角度分析,一般选A组药品,该组药品发生反应的化学方程式为_____;不选择C组药品的原因是:______。
Ⅱ选择装置。他想制取较多的二氧化碳,最好选择____(填序号)作为气体发生装置,该装置的优点是______。
【题目】氢氧化钙久置会逐渐变质为碳酸钙。实验室有一瓶部分变质的氢氧化钙样品,为测定其中碳酸钙的质量分数,取16.2g样品于烧杯中,加足量的水,再将100g稀盐酸逐渐缓慢加入烧杯中并不断搅拌,获得相关数据如下表(提示:氢氧化钙先与盐酸反应时无气体产生),请回答问题并计算。
加入稀盐酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100 |
生成CO2的质量/g | 0 | 2.2 | 4.4 | m | 5.5 |
(1)氢氧化钙变质是它与空气中的____________发生了反应。
(2)表中m的数值为_____________。
(3)试计算样品中碳酸钙的质量分数___________(请在答题卡上写出计算过程,计算结果精确到0.1%)。
(4)请在坐标中画出加入稀盐酸的质量与生成CO2的质量之间的变化关系图___________。

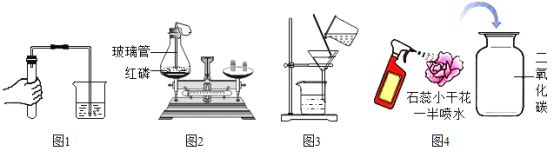
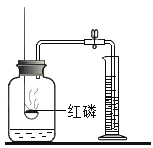
【题目】小明通过阅读《科学的历程》知道质量守恒定律的发现经历了漫长、曲折的过程。
历程与思考
历程一:早在1663年,英国化学家波义耳将金属汞放在密闭容器里煅烧,打开容器盖冷却后称量,得出的结论是物质的总质量增加了,导致波义耳与质量守恒定律失之交臂你认为质量增大的原因是_____。
历程二:1756年,俄国化学家罗蒙诺索素夫将金属锡放在密闭容器里煅烧,发现总质量和煅烧前没有变化。
历程三:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,得到了与罗蒙诺索夫相同的结论,从而总结出了质量守恒定律。拉瓦锡还通过这个实验研究了_____,成就了化学史上的另一经典实验。
验证与拓展
为了验证科学家们发现的质量守恒定律,小明设计了如图所示的三个实验,
(实验步骤)
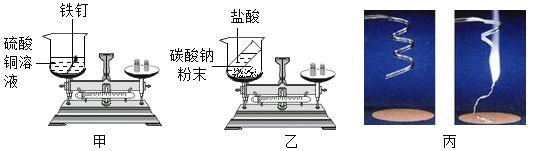
如图所示,甲、乙实验,用砝码使天平平衡后,随即使其发生反应,丙实验对石棉网和打磨干净的镁条进行反应前后的称量。三组实验小明都进行了规范的操作以及准确的称量和认真观察。请完成下表内容。
实验 | 实验现象 | 反应化学方程式 |
甲 | _____ |
|
乙 | _____ | _____ |
丙 | _____ | _____ |
(实验分析)通过对上述实验的对比分析,小明认为实验甲遵守质量守恒定律,而实验乙和丙不遵守质量守恒。小组同学认为小明这种说法不正确,请分析导致实验乙和丙反应前后称量质量不相等的原因_____。
(实验结论)化学反应都遵守质量守恒定律。
请从微观的角度分析化学反应遵循质量守恒的原因是_____。
(实验拓展)小明查阅资料发现,实验甲得到的铜在工业上能与氯化铜溶液和盐酸在50℃时反应制作电路,生成物经处理又能转化为氯化铜。反应如下:
①![]() ;②
;②![]() ;③
;③![]()
(1)反应②中X的化学式为_____。
(2)反应①中氯化铜的质量_____(填“=”或“<”或“>”)反应③中氯化铜的质量。
(3)反应①结束后,进行蒸发操作得到固体的质量为10.66g,其中铜元素的质量为6.4g该固体的成分为_____。