题目内容
化学小组同学利用右图装置(固定装置略)按如下操作进
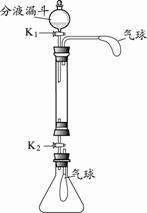 行实验,研究酸、碱、盐的性质。玻璃管中盛有氢氧化钠固体,锥形
行实验,研究酸、碱、盐的性质。玻璃管中盛有氢氧化钠固体,锥形
瓶中充满二氧化碳气体。
已知:碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应。
实验步骤如下:
步骤1:关闭K2,从分液漏斗中加入少量的稀盐酸后关闭K1,观察
到上面气球鼓起。甲同学认为气球鼓起是由于反应放热引起的,由此证明酸和碱能发生反应。请判断甲的说法是否合理并说明理由 。
步骤2:同时打开K1、K2,使玻璃管中的液体流入锥形瓶。并用清水冲洗玻璃管;关闭K2,一段时间后,锥形瓶内气球鼓起,原因是(用化学方程式表示) 。
步骤3:关闭K2,向玻璃管中加入滴有酚酞的氢氧化钙溶液,再从分液漏斗中加入一定量的稀盐酸,观察到 现象,证明酸和碱能反应。
步骤4:打开K1、K2,使玻璃管中的液体流入锥形瓶中,关闭K2,观察到锥形瓶中产生了大量气泡,气球变瘪,最终得到澄清溶液。请设计实验证明所得澄清溶液中溶质的组成 。
步骤1:不合理,氢氧化钠溶于水放热也会引起气球胀大
步骤2:CO2 + 2NaOH == Na2CO3 + H2O
步骤3:红色变浅或消失
步骤4:取一定量的澄清溶液于试管中,加入紫色石蕊溶液,若溶液无变化,则所得澄
清溶液中的溶质为NaCl、CaCl2;若溶液变红,则所得澄清溶液中的溶质为NaCl、CaCl2、HCl(2分)

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
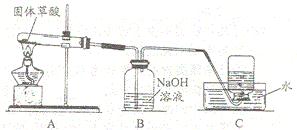
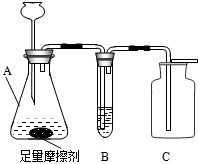 某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨: (2013?东城区二模)请你参与下列探究.
(2013?东城区二模)请你参与下列探究.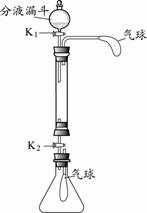 化学小组同学利用右图装置(固定装置略)按如下操作进
化学小组同学利用右图装置(固定装置略)按如下操作进