题目内容
【题目】实验室有一包白色粉末,设计实验初步证明白色粉末A的成分都是碳酸钠和氯化钠的混合物。有关数据如图所示:
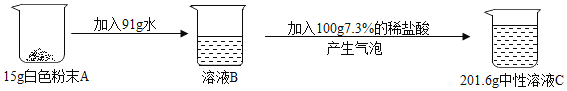
(1)写出题中发生反应的化学方程式_____;
(2)反应生成气体的质量_____;
(3)根据已知条件列出A中参加反应的固体质量(x)的比例式_____;
(4)A固体中两种成分质量比为_____;
(5)溶液B中碳酸钠溶质的质量分数为_____;
(6)若需质量分数为10%的C溶液,则需蒸发水_____。
【答案】Na2CO3+2HCl═2NaCl+H2O+CO2↑ 4.4g ![]() 53:22 10% 40.6
53:22 10% 40.6
【解析】
碳酸钠和氯化钠中只有碳酸钠和盐酸反应,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
根据质量守恒定律可得,生成的二氧化碳的质量为15g+91g+100g﹣201.6g=4.4g;
设:碳酸钠的质量为x,生成的氯化钠的质量为y。

![]() x=10.6g
x=10.6g
![]() y=11.7g
y=11.7g
A固体中两种成分质量比=10.6g:(15g﹣10.6g)=53:22;
溶液B中碳酸钠溶质的质量分数=![]() ;
;
若需质量分数为10%的C溶液,则需蒸发水的质量为![]() 。
。
答:(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)反应生成气体的质量 4.4g;
(3)根据已知条件列出A中参加反应的固体质量(x)的比例![]()
(4)A固体中两种成分质量比为 53:22;
(5)溶液B中碳酸钠溶质的质量分数为 10%;
(6)若需质量分数为10%的C溶液,则需蒸发水 40.6g。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究.选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸.采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据.已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图.读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16g | 2.2g |
② | 块状 | 9% | 1.42g | 2.2g |
③ | 粉末 | 16% | 2.33g | 2.2g |
④ | 粉末 | 9% | 1.93g | m2 |
(1)稀盐酸的浓度对该反应快慢的影响:_____.
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束_____.
(3)结合表格分析,实验④反应结束后m2的值_____.
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是_____.
(5)计算该大理石(6g)样品中含碳酸钙的质量为_____.