题目内容
【题目】自来水厂净水过程的主要操作流程如图:
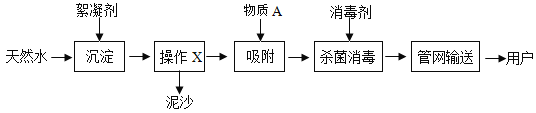
回答下列问题:
(1)操作X的名称是_____。
(2)高铁酸钾(K2FeO4)能作消毒剂与絮凝剂。高铁酸钾中铁元素的质量分数是_____%(保留一位小数)。
(3)吸附过程中,加入的物质A 为_____,利用它的吸附性对色素、异味等进行有效吸附。
(4)若经过操作①后,所得液体C中仍有浑浊,其原因可能是_____ (填序号)。
A 漏斗内的滤纸有破损 B 漏斗下端管口未靠在烧杯内壁 C 漏斗内液面高于滤纸的边缘
(5)保护水环境、珍爱水资源,是每个公民应尽的责任和义务。下列做法有利于保护水资源的是_____ (填序号)。
A 大量使用化肥农药 B 工业废水处理达标后排放
C 使用含磷洗衣粉 D 生活污水直接排放
【答案】过滤 28.3% 活性炭 AC B
【解析】
(1)由自来水厂净水流程图可得知,过滤可以除去水中的泥沙,操作X是过滤;
(2)高铁酸钾中铁元素的质量分数=![]() ;
;
(3)活性炭具有吸附性,可以吸附色素和异味,故试剂A的名称是活性炭;
(4)若经过过滤操作后,所得液体C中仍有浑浊,可能的原因较多,例如:滤纸破损、漏斗内液面高于滤纸边缘、承接滤液的仪器原本不干净等;
(5)工业废水处理达标后排放,有利于保护水资源;而大量使用化肥农药、使用含磷洗衣粉、生活污水直接排放等都会污染水资源;造成水质恶化。

【题目】碳元素是组成许多物质的基本元素。
甲烷在自然界的分布很广,和水反应可以制水煤气(混合气体),其反应的微观示意图如下所示:
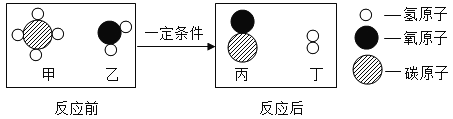
(1)该反应中含有氢元素的化合物有_________(用化学式表示);该反应中生成的两种分子的物质的量之比为_________。
(2)分析下表,与煤相比,用天然气作燃料的优点有________。
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/kJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |
【题目】化学小组围绕“铁丝在氧气中燃烧现象及产物”的问题,进行了探究。 实验室用过氧化氢溶液制氧气,反应的文字表达式_______________________________。
活动 1:“火星四射”的现象与铁丝含碳量的关系
实验操作 | 实验现象 | 实验结论 |
实验 1:取直径 0.20mm,含碳0.1%的铁丝,在氧气中燃烧 | 零星火星 | ①“火星四射”与铁丝含碳量的关系是______。 ② 此 实验 采用 的一 种研究 方 法 是_______。 |
实验 2:取直径_____________mm,含碳0.3%的铁丝,在氧气中燃烧 | 较明显的火星四射 |
活动 2:黑色固体中是否含有铁? 资料:铁粉是黑色或灰黑色粉末。四氧化三铁为黑色固体,具有磁性。小刚提出可以用磁铁来检验黑色固体是否含有铁,小明对小刚的方案表示质疑,你认为小刚的方案是否可行,其理由是____________________________________。
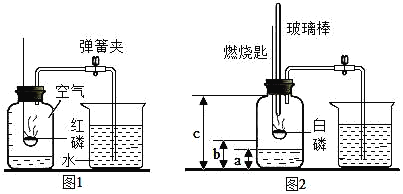
【题目】二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,我们可以用图1所示装置来测定空气中氧气的含量,请写出红磷燃烧的符号表达式_________________,该反应属于_________________反应(填一种基本反应类型)。
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)_______________,导致装置内氧气有剩余;(3)……
(实验与交流)在老师的指导下,同学们查阅了白磷、红磷等物质燃烧需要的最低含氧量如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用上述过量红磷、白磷、蜡烛三种物质进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度会不断变小,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与澄清石灰水反应。根据以上信息回答下列问题:
(1)白磷和红磷相比,使用白磷能使结果更准确,其原因是______________________。
(2)请写出木炭燃烧的符号表达式_________________;有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是________________。
(实验改进)小邹同学改进了教材中的实验,设计出了如图2所示的实验装置。实验步骤如下:
①如图2所示,连接仪器,检查装置的气密性,发现装置的气密性良好。
②在集气瓶里装进a体积的水,燃烧匙里放一块白磷(白磷燃烧所需要的最低温度是40℃),按图示装置把集气瓶中的空气密封起来。(注:集气瓶内的长导管已伸到了瓶底)。
③用力把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即燃烧,产生大量白烟,放出大量的热。
④待白磷燃烧熄灭后,振荡集气瓶,白烟消失。
⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c。
⑥根据a、b、c三个数据,计算出空气中氧气的体积分数。根据以上信息,回答下列问题;
(1)在白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化情况是_______。
(2)若实验非常成功,当c为500mL,a=100mL,则b= _______mL。
(3)组内成员小张对“实验前集气瓶里要装进适量a体积的水”非常不理解。咨询了组长小明之后,他终于明白“a体积的水”的作用,其一是为了加快步骤⑤中集气瓶的冷却速度;其二则主要是______________。
(4)在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值大于理论值的是_______________(填字母)。
A用蜡烛代替白磷
B集气瓶没有冷却到室温
C实验前集气瓶里没有装a体积的水


