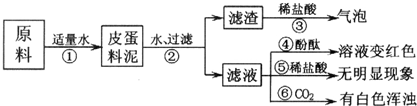
题目内容
3.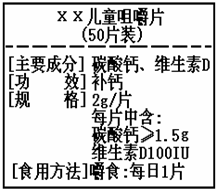 如图为“XX”钙片商品标签图,请根据标签的有关信息完成下列各题.
如图为“XX”钙片商品标签图,请根据标签的有关信息完成下列各题.(1)每片钙片中至少含钙元素的质量为0.6g.
(2)小花同学为测定其碳酸钙的含量标注是否属实,她取出10片钙片,研碎后放入小烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸30g,称量小烧杯中剩余物质的质量是43.4g(不含烧杯质量,假定钙片其它成分不与盐酸反应).
①生成的二氧化碳的质量为6.6g.
②通过计算判断该钙片中碳酸钙的含量标注是否属实.
分析 (1)根据该片中碳酸钙的含量以及碳酸钙中钙元素的质量分数来计算;
(2)①因钙反应中只有二氧化碳是气体,则可根据总质量守恒来计算生成二氧化碳的质量;
②根据二氧化碳的质量代入碳酸钙和盐酸反应的化学反应方程式来计算碳酸钙的质量,若碳酸钙的质量≥1.5g就属实,反之就不属实.
解答 解:(1)每片钙片中至少含有的碳酸钙的质量为1.5g,其中含有钙元素的质量为:1.5g×$\frac{40}{40+12+16×3}$×100%=0.6g.
(2)①因每片的质量为2g,10片钙片的质量为2g×10=20g,
根据质量守恒定律可知,生成二氧化碳的质量为20g+30g-43.4g=6.6g;
②设10片钙片中碳酸钙的质量为x,则
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 6.6g
$\frac{100}{x}$=$\frac{44}{6.6g}$
解得x=15g,
则每片中碳酸钙的质量为:15g÷10=1.5g,
因钙片商品标签图中的规格中标出每片中碳酸钙的含量≥1.5g,则属实,
答:该钙片中碳酸钙的含量标注属实.
故答案为:(1)0.6.
(2)①6.6;
②钙片中碳酸钙的含量标注属实.
点评 本题以信息为载体来考查学生分析问题并解决问题的能力,同时考查学生利用相关信息进行化学反应方程式的计算,注重了化学与生活的联系,也是以后习题的重要考查方向.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.食醋是厨房的一种调味品,其中含有少量醋酸(CH3COOH).下列有关醋酸的说法正确的是( )
| A. | 醋酸是一种氧化物 | |
| B. | 醋酸中碳元素的质量分数为40% | |
| C. | 醋酸是由碳、氢、氧三种原子构成的 | |
| D. | 醋酸中碳、氢、氧三种元素的质量比为2:4:2 |
11.密闭容器中有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后个物质的质量如下表所示.下列说法正确的是( )
| 物质 | a | b | c | d |
| 反应前质量/g | 6.40 | 3.20 | 4.00 | 0.50 |
| 反应后质量/g | X | 2.56 | 7.20 | 0.50 |
| A. | d一定是催化剂 | |
| B. | 表中X为2.56 | |
| C. | 该反应为分解反应 | |
| D. | c中元素的种类等于a、b中两种物质中元素的种类之和 |
18.一氧化氮是汽车尾气中的一种大气污染物,它是无色气体,难溶于水、密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮.在实验室中,收集一氧化氮时可选用的收集方法是( )
| A. | 排水法或向上排空气法 | B. | 排水法 | ||
| C. | 向上排空气法 | D. | 向下排空气法 |
15.下列物质名称、俗名(或主要成分)、化学式不一致的是( )
| A. | 碳酸钙 石灰石 CaCO3 | B. | 氢氧化钙 熟石灰 Ca( OH)2 | ||
| C. | 一氧化碳 天然气 CO | D. | 氧化钙 生石灰 CaO |
12.下列过程只发生物理变化的是( )
| A. | 光合作用 | B. | 酒精挥发 | C. | 钢铁生锈 | D. | 镁带燃烧 |