题目内容
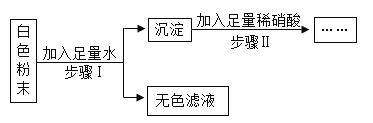
【题目】现有一块表面已氧化的铝片,向其中加入足量稀盐酸(铝与稀盐酸反应生成氯化铝和氢气),反应过程如图所示。
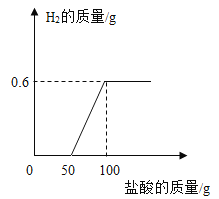
(1)计算铝片中铝的质量_____。
(2)反应后测得溶液中有53.4g氯化铝,计算原混合物的质量_____。
【答案】5.4g 15.6g
【解析】
(1)由图可知,反应生成氢气的质量为0.6g
设铝片中铝的质量为x,铝与稀盐酸反应生成氯化铝的质量为y。
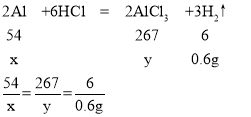
x=5.4g
y=26.7g
答:计算铝片中铝的质量为5.4g;
(2)由题可得,氧化铝与稀盐酸反应生成的氯化铝的质量为:53.4g-26.7g=26.7g
设原混合物中氧化铝的质量为z

z=10.2g
故原混合物的质量为5.4g+10.2g=15.6g
答:原混合物的质量是15.6g。

练习册系列答案
相关题目
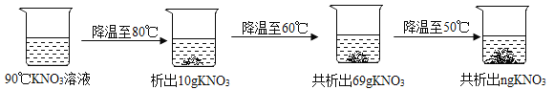
【题目】下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
(1)影响固体物质溶解度大小的因素除温度外还有_____(填一种)。
(2)40℃时KNO3溶液中溶质的质量分数的最大值是_____(只列出表达式)。
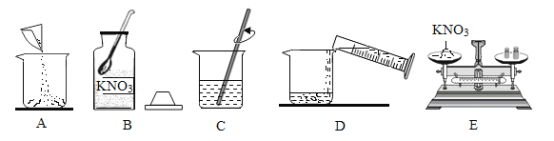
(3)90℃时,将一定质量的KNO3溶液按图示进行操作,图中n的数值为_____。
(4)下图为某同学配制一定溶质质量分数的硝酸钾溶液的实验操作示意图,该实验正确的操作顺序是_____(填字母)。