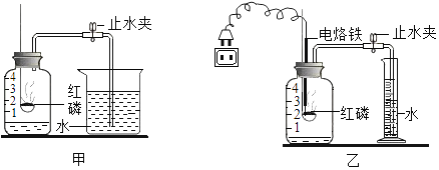
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀士氧化物。某品牌平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。以此粉末为原料进行资源回收,其工艺流程如下:
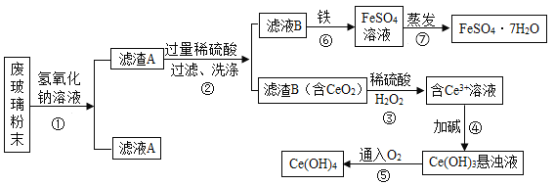
已知:![]() ,Na2SiO3溶于水。
,Na2SiO3溶于水。
(1)第①步操作的名称是_____。
(2)第②步加入过量稀硫酸的目的是_____。
(3)洗涤滤渣B的目的是为了除去_____(填离子符号),提高产品的纯度。
(4)第⑦步操作是把FeSO4溶液经蒸发浓缩、_____、过滤、洗涤、干燥等步骤得到绿矾FeSO4·7H2O。
(5)若第④步加的碱为NaOH,写出该反应的化学方程式_____。
【答案】过滤 除去氧化铁 Fe3+ 冷却结晶 ![]()
【解析】
废玻璃粉末中含SiO2、Fe2O3、CeO2等物质,加入氢氧化钠溶液,氧化铁和二氧化铈不溶于氢氧化钠溶液,二氧化硅溶于氢氧化钠溶液,二氧化硅和氢氧化钠反应生成硅酸钠和水,所以过滤之后,滤液A是硅酸钠溶液,滤渣A是氧化铁和二氧化铈,再向滤渣中加入过量稀硫酸,氧化铁和稀硫酸反应生成硫酸铁和水,二氧化铈不反应,过滤之后,滤液B是硫酸铁溶液,向滤液中加入铁粉,得到硫酸亚铁溶液,蒸发浓缩,冷却结晶得到FeSO4·7H2O晶体;滤渣B是二氧化铈,再向滤渣中加入稀硫酸和过氧化氢溶液生成Ce2(SO4)3溶液,加碱得到Ce(OH)3悬浊液,通入氧气,得到Ce(OH)4。
(1)第①步操作得到滤渣和滤液,所以是过滤;
(2)根据分析可知,第②步加入过量稀硫酸的目的是除去氧化铁;
(3)根据分析可知,滤渣B表面可能有硫酸铁溶液,所以洗涤滤渣B的目的是为了除去Fe3+,提高产品的纯度;
(4)第⑦步操作是把FeSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤得到绿矾FeSO4·7H2O;
(5)根据分析可知,Ce2(SO4)3和NaOH反应生成Ce(OH)3和Na2SO4,化学方程式为:![]() 。
。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案