题目内容
【题目】某化学兴趣小组选用如图所示装置进行二氧化碳的制取和性质实验.请你根据所学知识,依图回答下列问题:
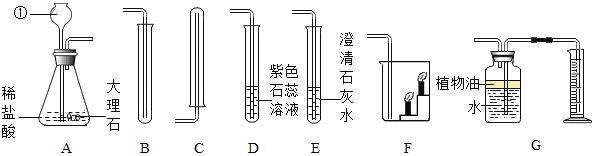
(1)仪器 ①是_____,请写出A中发生反应的化学方程式_____。
(2)收集少量CO2气体应选择_____ (填装置序号),验满的方法是_____。
(3)若A与D连接,则D中出现的现象是_____,原因是_____(用化学方程式表示)。
(4)若A与E连接,E中发生反应的化学方程式为_____。
(5)若A与F连接,则F中出现的现象是_____,说明了CO2具有_____ 的化学性质,因此CO2可用于_____。
(6)G可用来测量生成CO2的体积,在水面上放一层植物油的目的是_____,植物油上方原有的空气对实验的结果_____ (填“有”或“没有”)明显影响。
【答案】长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ B 用燃着的木条放在试管口,若火焰熄灭,则已收满 紫色的溶液变成红色 CO2+H2O=H2CO3 CO2+Ca(OH)2═CaCO3↓+H2O 低的蜡烛先熄灭,高的蜡烛后熄灭 不能燃烧、不能支持燃烧 灭火 防止CO2溶于水且与水反应 没有
【解析】
(1)通过分析题中所指仪器的作用可知,①是长颈漏斗,大理石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)二氧化碳的密度比空气大且溶于水与水反应,所以收集少量的二氧化碳可用B装置;二氧化碳不燃烧,也不支持燃烧,故验满的方法是:用燃着的火柴放在试管口,若火焰熄灭,则已收满;
(3)二氧化碳与水反应生成碳酸,碳酸是一种酸,能使紫色的石蕊试液变红色,化学方程式为:CO2+H2O=H2CO3;
(4)二氧化碳与澄清的石灰水反应生成碳酸钙白色沉淀和水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(5)二氧化碳的密度比空气大,不需要通过化学变化表现出来,属于二氧化碳的物理性质。二氧化碳不能燃烧,不支持燃烧,需要通过化学变化表现出来,属于二氧化碳的化学性质。若A与F连接,则F中出现的现象是矮的蜡烛先熄灭,高的蜡烛后熄灭;说明二氧化碳的密度比空气大,不能燃烧,不支持燃烧,所以二氧化碳可以用来灭火;
(6)G可用来测量生成CO2的体积,在水面上放一层植物油的目的是防止CO2溶于水且与水反应;
该实验是通过测定排出水的体积来测量生成二氧化碳的体积,故植物油上方原有的空气对实验的结果没有明显影响。

【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。