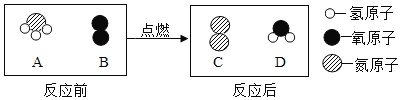
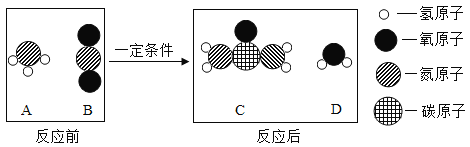
题目内容
【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下
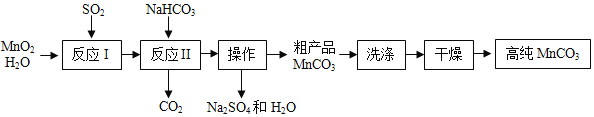
已知:①反应I的化学方程式:![]() ;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 °C时开始分解。
;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 °C时开始分解。
(1)反应I属于基本反应类型中的__反应。
(2)反应Ⅱ的化学方程式为_____。该反应需控制溶液的酸碱性,若碱性过强,MnCO3 粗产品中将混有_____(填化学式)。
(3)MnCO3粗产品表面附着有杂质__(填化学式);验证完全除去该杂质的操作,取样品少许,向其中加入___,搅拌、过滤,向滤液中加入适量的___(填化学式)溶液,观察到__。
(4)为获得高纯MnCO3,需选择干燥的条件是__(填字母)。
A 低温 B 高温 C 高于100 °C
【答案】化合 ![]() Mn(OH)2 Na2SO4 适量水 BaCl2(合理即可) 没有白色沉淀生成 A
Mn(OH)2 Na2SO4 适量水 BaCl2(合理即可) 没有白色沉淀生成 A
【解析】
(1)反应I的化学方程式为![]() ,该反应是由两种物质生成一种物质的反应,属于化合反应;
,该反应是由两种物质生成一种物质的反应,属于化合反应;
(2)根据流程图和质量守恒定律可知,反应Ⅱ是MnSO4与NaHCO3反应生成MnCO3、CO2、Na2SO4和H2O,反应的化学方程式为:![]() ;该反应需控制溶液的酸碱性,若碱性过强,MnCO3 粗产品中将混有Mn(OH)2;
;该反应需控制溶液的酸碱性,若碱性过强,MnCO3 粗产品中将混有Mn(OH)2;
(3)根据反应Ⅱ可知,MnCO3粗产品表面附着有杂质Na2SO4;MnCO3不溶于水,Na2SO4溶于水,硫酸钠与氯化钡反应能生成硫酸钡的白色沉淀。验证完全除去该杂质的操作,取样品少许,向其中加入适量水,搅拌、过滤,向滤液中加入适量的BaCl2溶液,观察到没有白色沉淀生成;
(4)根据“MnCO3在100 °C时开始分解”可知,为获得高纯MnCO3,需选择干燥的条件是低温。故选A。

 阅读快车系列答案
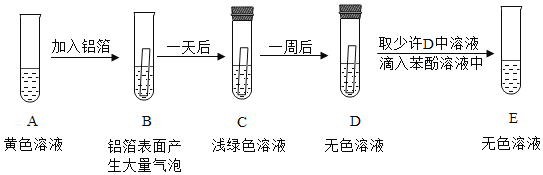
阅读快车系列答案【题目】铜、铝两种金属的抗腐蚀性都比较优良。兴趣小组分工协作进行探究。
[查阅资料]:常温下,铝不与水发生反应;硫酸铝、氯化铝溶液为无色。
活动一:探究铝的抗腐蚀性优良的原因。
如图所示,将铝条在酒精喷灯上灼烧,发现熔化了的铝并未掉下来,被包裹在一个“小袋子”中,下面实验分析正确的是_____。

A 氧化铝的熔点比铝高
B “小袋子”是致密的氧化铝薄膜
C 铝的化学性质不活泼
活动二:验证铝与铜的金属活动性。
[选择药品]:I铝条和硫酸铜溶液;II_____, 两组药品都可以完成实验目的。
[进行实验]:同学们选择I中药品进行实验
操作步骤 | 实验现象 | 分析与结论 |
取一支洁净的试管,注入少量的硫酸铜溶液,放入铝条。 | 无明显现象 | 现象与理论不符,同学们讨论,发现了问题,重新改进该实验。 |
改进实验:取一支洁净的试管, 注入少量的硫酸铜溶液,_____。 | _____ | 铝比铜活泼。反应化学方程式为_____。 |
[发现问题]:在该实验中发现铝条表面出现少量气泡,经查阅气体为氢气。产生该现象可能的原因是_____。
【题目】Mg(OH)2 具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含 MgSO4 和 H2SO4 的混合溶液,为确定混合溶液中镁的含量,取 4 份混合溶液各 100g 向每份混合溶液中加入一定质量的 4%NaOH 溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH 溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
求:100g 混合溶液中含 MgSO4 的质量为多少 g?(要求写出完整计算过程)