题目内容
有等质量的两种金属A和B,前者放入质量分数为10%的稀硫酸中,后者放入质量分数为20%的稀盐酸中,产生氢气的质量随时间变化曲线如图所示。下列说法错误的是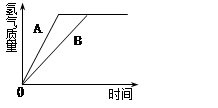
| A.产生氢气物质的量相等 | B.金属的活泼性A>B |
| C.酸过量,金属质量不足 | D.A与硫酸反应更为剧烈 |
C
解析试题分析:A、据图可直接看出,产生氢气物质的量相等,正确,B、同样据图可直接看出,金属A与酸反应的时间更短,说明反应速率更快,故金属的活泼性A>B,正确,C、若酸过量,金属不足(即金属全部反应),这时计算氢气的质量就应该用金属的质量来求算,金属A和B质量相等,而相对原子质量不相等,这样产生的氢气质量就一定不会相等,这跟图中反应出来的产生氢气质量相等相违背,所以错误,D、因为金属的活泼性A>B,所以可判断A与硫酸反应更为剧烈,正确,故选C
考点:金属与酸反应的应用

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案下列四个实验中只需要完成三个就可以证明Fe、Cu、Ag三种金属的活动性顺序.其中不必进行的是( )
| A.将铁片放入稀盐酸 | B.将铜片放入稀盐酸 |
| C.将铁片放入硝酸银溶液 | D.将铜片放入硝酸银溶液 |
下列可用于验证铜、铁、锌三种金属的活动性强弱的一组药品是
①Cu、Zn、FeSO4溶液 ②Cu、Fe、ZnSO4溶液
③Cu、FeSO4溶液、ZnSO4溶液 ④Fe、CuSO4溶液、ZnSO4溶液
| A.①② | B.①④ | C.②③ | D.③④ |
向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为
| A.Ag、Cu两种单质的混合物 | B.Cu、Fe两种单质的混合物 |
| C.Ag、Fe两种单质的混合物 | D.Ag、Cu、 Fe三种单质的混合物 |
设计实验判断Fe、Cu、Ag的金属活动性顺序正确的是
| A.铁丝分别放入硝酸铜溶液和硝酸银溶液 |
| B.铁丝放入硝酸铜溶液,铜丝放入硝酸银溶液 |
| C.铜丝放入硝酸亚铁溶液,铁丝放入硝酸银溶液 |
| D.银丝分别放入硝酸铜溶液和硝酸亚铁溶液, |
现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是 ( )
| A.生成氢气的质量:甲>乙>丙 |
| B.金属活动性:乙>甲>丙 |
| C.相对原子质量:乙>丙>甲 |
| D.消耗硫酸的质量:甲>乙>丙 |
下列有关二氧化碳的说法错误的是( )
| A.在空气中二氧化碳的体积分数约为0.03% | B.二氧化碳有毒,不能供人呼吸 |
| C.过多的二氧化碳排放会导致温室效应 | D.干冰可用于人工降雨 |
某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列有关说法中,正确的是( )
| A.滤出的固体中一定含有银和铜,一定不含铁 |
| B.滤出的固体中一定含有银,可能含有铜和铁 |
| C.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜 |
| D.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜 |