题目内容
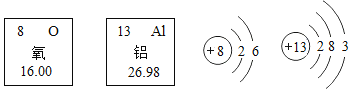
【题目】人类一直在探索宇宙的奥秘。月球上含有H、![]() 、N、
、N、![]() 、
、![]() 、
、![]() 等元素,未来可能会成为人类宝贵的资源。根据下图回答:
等元素,未来可能会成为人类宝贵的资源。根据下图回答:
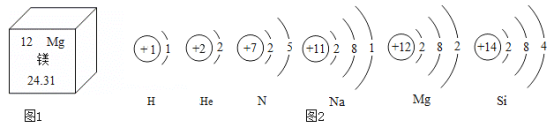
(1)镁原子的相对原子质量是______。
(2)![]() 是高效械能原料,其原子的核外电子数是______。
是高效械能原料,其原子的核外电子数是______。
(3)根据图2信息和所学知识分析,下列说法正确的是______。
A 氢气由氢原子构成 B N原子有两个电子层 C ![]() 和
和![]() 的化学性质相似
的化学性质相似
(4)钠是一种活泼金属,与氯气反应的化学方程式为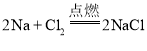 ,该反应的基本类型是________,
,该反应的基本类型是________,![]() 中钠离子的符号是________。
中钠离子的符号是________。
(5)氮化镁(![]() )的相对分子质量是_______。
)的相对分子质量是_______。
(6)一壶水烧开后,壶盖被顶开,这是由于_______________。
【答案】24.31 2 B 化合反应 ![]() 100 水由液态变成气态,水分子间空隙变大,水的体积膨胀,导致壶内压强增大
100 水由液态变成气态,水分子间空隙变大,水的体积膨胀,导致壶内压强增大
【解析】
(1)根据元素周期表的意义可知:镁原子的相对原子质量是24.31;
(2)原子中,质子数=核外电子数,氦原子的核外电子数是2;
(3)A.氢气由氢分子构成,故错误;
B.由N原子结构示意图可知:N原子有两个电子层,故正确;
C.He属于稳定结构,Mg最外层电子数为2,易失去电子,He和Mg的化学性质不相似,故错误;
(4)钠是一种活泼金属,与氯气反应的化学方程式为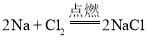 ,该反应符合化合反应多变一的特征,钠离子的符号为Na+;
,该反应符合化合反应多变一的特征,钠离子的符号为Na+;
(5)氮化镁的相对分子质量为24×3+14×2=100.
(6)一壶水烧开后,壶盖被顶开,这是由于水由液态变成气态,水分子间空隙变大,水的体积膨胀,导致壶内压强增大。
答案:
(1)24.31;(2)2;(3)B;(4)化合反应;![]() ;(5)100;(6)水由液态变成气态,水分子间空隙变大,水的体积膨胀,导致壶内压强增大。
;(5)100;(6)水由液态变成气态,水分子间空隙变大,水的体积膨胀,导致壶内压强增大。

 阅读快车系列答案
阅读快车系列答案【题目】甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 | 检测结果 | |
甲同学 | 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 | pH>7 |
乙同学 | 将pH试纸直接浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 | pH>7 |
(1)碳酸钠的化学式为__________,它属于________(填酸、碱、盐、氧化物)
(2)根据两位同学的实验可得出碳酸钠溶液酸碱性的结论:__________________
(3)根据两位同学的实验操作,你认为_________同学操作不规范。为什么?_____________。
(4)如果实验室没有pH试纸,又要一次测定未知溶液的酸碱性,可选用__________试液来进行实验。