题目内容
把6.2g 氯化钠和纯碱的混合物完全溶解在50g水中恰好与36g某盐酸溶液完全反应,测得反应后溶液的质量为90g,求:
(1)混合物中纯碱的质量分数?
(2)反应后所得溶液的溶质质量分数是多少?
解:(1)反应生成的二氧化碳气体的质量为:6.2g+50g+36g-90g=2.2g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g


解得,x=5.3g
y=5.85g
该纯碱样品的纯度为: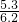 ×100%=85.5%
×100%=85.5%
(2)纯碱样品中所含的氯化钠的质量为:6.2g-5.3g=0.9g
反应后溶液中溶质氯化钠的质量为:5.85g+0.9g=6.75g
反应后溶液中溶质的质量分数为: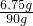 ×100%=7.5%
×100%=7.5%
答:(1)该纯碱样品的纯度为85.5%.
(2)所得溶液中溶质的质量分数为7.5%.
分析:(1)因为碳酸钠和盐酸反应有二氧化碳气体产生,所以反应后溶液的质量比反应前物质的总质量减少了,根据质量守恒定律可知,反应后减少的质量即为生成的二氧化碳气体的质量;根据碳酸钠和盐酸反应的化学方程式,由生成的二氧化碳的质量可得到碳酸钠的质量,进而求出纯碱样品的纯度;
(3)同样根据方程式利用二氧化碳的质量可求出生成的氯化钠的质量,最后求出反应后溶液中溶质的质量分数.
点评:此题是溶质的质量分数和化学方程式相结合的计算题,此题容易出错的地方是计算反应后溶液中溶质氯化钠的质量时,容易漏掉纯碱中所含的氯化钠.另外掌握住运用质量守恒计算生成气体的质量是解答此类题常用的方法.
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g


解得,x=5.3g
y=5.85g
该纯碱样品的纯度为:
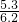 ×100%=85.5%
×100%=85.5%(2)纯碱样品中所含的氯化钠的质量为:6.2g-5.3g=0.9g
反应后溶液中溶质氯化钠的质量为:5.85g+0.9g=6.75g
反应后溶液中溶质的质量分数为:
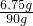 ×100%=7.5%
×100%=7.5%答:(1)该纯碱样品的纯度为85.5%.
(2)所得溶液中溶质的质量分数为7.5%.
分析:(1)因为碳酸钠和盐酸反应有二氧化碳气体产生,所以反应后溶液的质量比反应前物质的总质量减少了,根据质量守恒定律可知,反应后减少的质量即为生成的二氧化碳气体的质量;根据碳酸钠和盐酸反应的化学方程式,由生成的二氧化碳的质量可得到碳酸钠的质量,进而求出纯碱样品的纯度;
(3)同样根据方程式利用二氧化碳的质量可求出生成的氯化钠的质量,最后求出反应后溶液中溶质的质量分数.
点评:此题是溶质的质量分数和化学方程式相结合的计算题,此题容易出错的地方是计算反应后溶液中溶质氯化钠的质量时,容易漏掉纯碱中所含的氯化钠.另外掌握住运用质量守恒计算生成气体的质量是解答此类题常用的方法.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
小明想用粗盐配制50g 5%的氯化钠溶液,他设计了以下三个实验步骤,请你认真阅读小明的整个实验过程,并在有错误的语句下方划线(提示:共有6处错误).
| 实验步骤 | 操作过程 |
| 粗盐提纯 | 小明取粗盐少量放入烧杯中,加适量水,用玻璃棒搅拌,待粗盐充分溶解后,把浑浊的食盐水直接倒入已安装好的过滤器中,再将得到的滤液在蒸发皿中加热,一直到滤液完全蒸干,停止加热. |
| 配制溶液 | 小明计算了配制50g 5%的氯化钠溶液需氯化钠2g、水48g,然后用托盘天平和10mL量筒称量和量取所需的氯化钠和水,再把它们倒入烧杯中,用玻璃棒搅拌. |
| 测定溶液的pH | 小明用玻璃棒蘸取配制好的氯化钠溶液滴在用水润湿的pH试纸上,将试纸的颜色跟比色卡对照,结果pH=7.小明判断该溶液显酸性. |