题目内容
钢铁工业是国家工业的基础,新中国成立后,我国的钢铁工业得到了飞速的发展.2002年,我国的钢产量为18224.89万吨,连续多年保持世界第一.常见的铁矿石有:磁铁矿(主要成分是Fe3O4)、赤铁矿(主要成分是Fe2O3)、褐铁矿(主要成分是Fe2O3?xH2O)、菱铁矿(主要成分是FeCO3)、黄铁矿(主要成分是FeS2).请回答下列问题:(1)你认为上述几种铁矿石中理论上最适宜炼铁的两种矿石为
(2)请你利用如图中所提供的3个数据,自拟一道有关化学方程式的计算题,并写出解答过程.
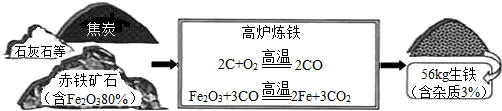
分析:炼铁时铁矿石的选择依据:铁的含量高,对环境的有污染的物质少.
只有熟悉含杂质物质的化学方程式的计算,才能编出相关的试题,才能正确解答这类题目.
只有熟悉含杂质物质的化学方程式的计算,才能编出相关的试题,才能正确解答这类题目.
解答:解:(1)通过计算可知磁铁矿、赤铁矿、褐铁矿、菱铁矿和黄铁矿的主要成分中铁元素的质量分数分别为:
72.4%、70%、<70%、48.3%、46.7%,因此从铁元素含量较高方面应选磁铁矿和赤铁矿;
磁铁矿和赤铁矿中不含或少含有害元素,冶炼是对环境污染小,所以应选磁铁矿和赤铁矿.
(2)生产56kg含杂质3%的生铁需要含氧化铁80%的赤铁矿石多少kg?
解:设需氧化铁质量为x.
则纯铁的质量为:56kg×(1-3%)=54.32kg
3CO+Fe2O3
2Fe+3CO2
160 112
x 54.32kg
=
,x=77.6kg
需赤铁矿的质量为:77.6kg÷80%=97kg
故答案为:
(1)磁铁矿、赤铁矿;铁的百分含量高,有害元素少,冶炼时所产生的污染少.
(2)需赤铁矿的质量为97kg.
72.4%、70%、<70%、48.3%、46.7%,因此从铁元素含量较高方面应选磁铁矿和赤铁矿;
磁铁矿和赤铁矿中不含或少含有害元素,冶炼是对环境污染小,所以应选磁铁矿和赤铁矿.
(2)生产56kg含杂质3%的生铁需要含氧化铁80%的赤铁矿石多少kg?
解:设需氧化铁质量为x.
则纯铁的质量为:56kg×(1-3%)=54.32kg
3CO+Fe2O3
| ||
160 112
x 54.32kg
| 160 |
| 112 |
| x |
| 54.32kg |
需赤铁矿的质量为:77.6kg÷80%=97kg
故答案为:
(1)磁铁矿、赤铁矿;铁的百分含量高,有害元素少,冶炼时所产生的污染少.
(2)需赤铁矿的质量为97kg.
点评:本题主要考查铁矿石的选择和有关含杂质物质的化学方程式计算,难度较大.

练习册系列答案
相关题目
钢铁工业是国家工业的基础.2007年我国粗钢产量接近5亿吨,居世界前列.湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃.某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%).
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
①计算硫酸溶液中溶质的质量 g
②求在实验3中反应后所得的溶液中溶质的质量分数?
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
序数 质量 |
实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
②求在实验3中反应后所得的溶液中溶质的质量分数?
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?

 序数
序数