题目内容
【题目】垃圾处理厂对某小区的生活垃圾进行综合处理,回收单质锌并制备锌的化合物,部分流程如下(部分产物已略去):
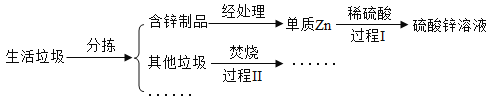
(1)过程I中,伴随有气体生成,该气体是________(写名称),产生该气体的化学方程式为_____。
(2)过程Ⅱ产生的烟气中常含有害气体SO2,直接排放此烟气对环境造成的影响是_________。工厂常采用石灰浆[主要成分Ca(OH)2]来吸收SO2,该反应同CO2与石灰浆的反应类似,请写出用足量石灰浆吸收SO2的化学方程式__________。
(3)垃圾焚烧时产生的能量可用于____________(写一种)。
【答案】氢气 Zn+H2SO4=ZnSO4+H2![]() 容易形成酸雨,对植物等造成伤害 Ca(OH)2+SO2=CaSO3
容易形成酸雨,对植物等造成伤害 Ca(OH)2+SO2=CaSO3![]() +H2O 发电
+H2O 发电
【解析】
(1)过程I中,锌和稀硫酸反应产生氢气;
反应的化学方程式为Zn+H2SO4=ZnSO4+H2![]() ;
;
(2)直接排放此烟气对环境造成的影响是容易形成酸雨,对植物等造成伤害;
足量石灰浆吸收SO2的化学方程式为Ca(OH)2+SO2=CaSO3![]() +H2O;
+H2O;
(3)垃圾焚烧时产生的能量可用于发电。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
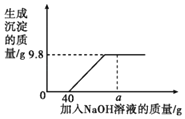
【题目】钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用10g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图像如下。请根据有关信息回答问题。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入盐酸的质量(g) | 20 | 20 | 20 | 20 | 20 |
生成气体的质量(g) | 0.6 | 1.2 | 1.8 | 2.2 | a |
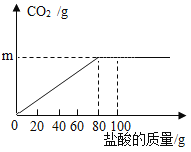
(1)a的数值为_____。
(2)求该品牌补钙剂中CaCO3的质量分数____。(写出计算过程,计算结果保留一位小数)