题目内容
小冬同学家买回一袋钾肥,其包装袋上部分说明如下图所示.小冬取10g该钾肥,加入40g水溶解后,与足量的BaCl2溶液充分反应,并测得生成沉淀的质量为11.65g.(1)如果钾肥的纯度(即钾肥中的K2SO4的质量分数)符合标准,则小冬配制的K2SO4溶液的溶质质量分数是多少?
(2)该钾肥的纯度是否符合包装袋上的说明?
(提示:K2SO4+BaCl2=BaSO4+2KCl)

【答案】分析:(1)计算10g样品中K2SO4的质量分数是按照符合标准的,所以可以求算样品中的硫酸钾的质量,之后再求算溶液中的硫酸钾的质量分数(此时理解为杂质也溶解于水);
(2)样品中硫酸钾的质量可通过反应的化学方程式,由生成沉淀硫酸钡的质量11.65g计算出来.K2SO4的质量分数与包装袋上说明相比较,确定该化肥纯度是否符合包装袋上的说明.
解答:解:(1)当样品的硫酸钾含量符合标准时,所得溶液中硫酸钾的质量分数= ×100%=19%
×100%=19%
(2)10g样品中K2SO4的质量分数= ×100%,其中样品中硫酸钾的质量可通过反应的化学方程式,由生成沉淀硫酸钡的质量11.65g计算出来;
×100%,其中样品中硫酸钾的质量可通过反应的化学方程式,由生成沉淀硫酸钡的质量11.65g计算出来;
设10g样品中含硫酸钾的质量为x
K2SO4+BaCl2═BaSO4↓+2KCl
174 233
x 11.65g
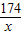 =
=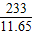
x=8.7g
该化肥中硫酸钾的质量分数=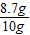 ×100%=87%.
×100%=87%.
化肥中硫酸钾的质量分数87%<95%,该化肥纯度不符合包装袋上的说明.
故答案为:(1)19% (2)化肥中硫酸钾的质量分数87%<95%,该化肥纯度不符合包装袋上的说明.
点评:根据反应的化学方程式可以表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.
(2)样品中硫酸钾的质量可通过反应的化学方程式,由生成沉淀硫酸钡的质量11.65g计算出来.K2SO4的质量分数与包装袋上说明相比较,确定该化肥纯度是否符合包装袋上的说明.
解答:解:(1)当样品的硫酸钾含量符合标准时,所得溶液中硫酸钾的质量分数=
 ×100%=19%
×100%=19%(2)10g样品中K2SO4的质量分数=
 ×100%,其中样品中硫酸钾的质量可通过反应的化学方程式,由生成沉淀硫酸钡的质量11.65g计算出来;
×100%,其中样品中硫酸钾的质量可通过反应的化学方程式,由生成沉淀硫酸钡的质量11.65g计算出来;设10g样品中含硫酸钾的质量为x
K2SO4+BaCl2═BaSO4↓+2KCl
174 233
x 11.65g
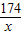 =
=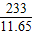
x=8.7g
该化肥中硫酸钾的质量分数=
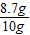 ×100%=87%.
×100%=87%.化肥中硫酸钾的质量分数87%<95%,该化肥纯度不符合包装袋上的说明.
故答案为:(1)19% (2)化肥中硫酸钾的质量分数87%<95%,该化肥纯度不符合包装袋上的说明.
点评:根据反应的化学方程式可以表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 小冬同学家买回一袋钾肥,其包装袋上部分说明如下图所示.小冬取10g该钾肥,加入40g水溶解后,与足量的BaCl2溶液充分反应,并测得生成沉淀的质量为11.65g.
小冬同学家买回一袋钾肥,其包装袋上部分说明如下图所示.小冬取10g该钾肥,加入40g水溶解后,与足量的BaCl2溶液充分反应,并测得生成沉淀的质量为11.65g.

