题目内容
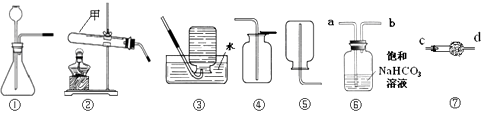
【题目】实验室有氧化铜和锌的混合粉末,为提炼其中的铜,取两份等质量的样品,分别按下图两个方案进行实验:
方案一: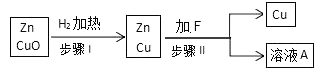
(1)写出步骤 I 中反应的化学方程式 , 该反应的反应类型为。
步骤 II 中加入的溶液 F 可能是。
(2)方案二: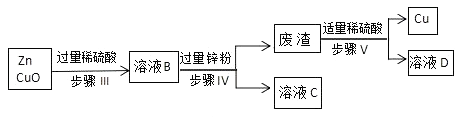
(3)步骤Ⅳ操作的名称是。
(4)步骤 III 中反应的化学方程式。
(5)上述实验体现了锌的活动性比铜。
(6)两个方案你认为哪个更简易,并说明理由。
【答案】
(1)H2+CuO ![]() Cu+H2O;置换反应;CuSO4或 H2SO4
Cu+H2O;置换反应;CuSO4或 H2SO4
(2)[
]
(3)过滤
(4)Zn+H2SO4= H2↑ + ZnSO4(或 H2SO4+CuO=CuSO4+H2O)
(5)强
(6)方案 2,不需要加热操作比较简单
【解析】方案一:(1). 氢气与金属氧化物反应生成金属和水,反应方程式为:H2+CuO ![]() Cu+H2O ,属于置换反应。 (2).CuSO4或 H2SO4;
Cu+H2O ,属于置换反应。 (2).CuSO4或 H2SO4;
方案二: (3)过滤可将难溶性固体铜与溶液分离,得铜和硫酸锌溶液; (3) Zn+H2SO4= H2↑ + ZnSO4 , H2SO4+CuO=CuSO4+H2O)
(6). 锌的活动性比铜的强。 (7). 由流程图可知方案 2更简单,因为不需要加热操作比较简单
【考点精析】本题主要考查了过滤操作的注意事项和金属材料的选择依据的相关知识点,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属才能正确解答此题.

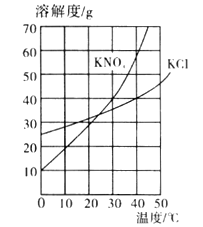
【题目】已知氯化钠、碳酸钠在不同温度时的溶解度如表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
(1)依据上表,绘制了氯化钠和碳酸钠的溶解度曲线(如图),图中能表示碳酸钠溶解度曲线的是 (填“A”或“B”);

(2)图中两溶解度曲线相交于M点,此点表示的意义是 ;
(3)40℃时,把50g A物质放入100g水中,充分搅拌,所得溶液是 (填“饱和”或“不饱和”)溶液;
(4)生活在盐湖(湖水中溶解有较多的氯化钠和碳酸钠)附近的人们习惯“夏天晒盐(NaCl),冬天捞碱(Na2CO3)”.请你答出“冬天捞碱”的道理: .