题目内容
【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
[查阅资料]①草酸晶体(H2C2O4·3H2O)在浓硫酸作用下受热分解,化学方程式为:![]()
②碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
③铁的常见氧化物中铁的质量分数:
[问题讨论]为了测定铁红中铁的质量分数,小组间学生进行如下实验。
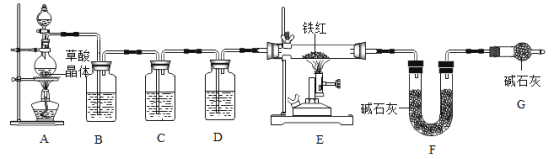
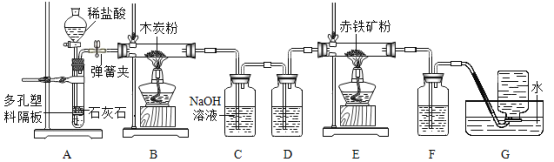
(1)实验前应先连接好仪器并_____。
(2)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)。
a.浓硫酸
b.澄清的石灰水
c.氢氧化钠溶液
(3) C装置的作用是_____。
(4)写出E装置中所发生反应的一个化学方程式:_____。
(5)称取铁红样品1.0用上述装置进行实验,若实验价后称得F装置增重7.7g.则此铁红中铁元素的质量分数是_____。
[实验反思]
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是_____。
【答案】检查装置的气密性 cba 证明CO2气体被吸收完全或检验CO2是否除净 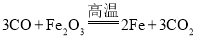 72.0% 偏小 缺少尾气处理装置
72.0% 偏小 缺少尾气处理装置
【解析】
问题讨论:
(1)有气体参与的反应需要检验装置气密性,所以实验前应先连接好仪器并检查装置气密性;
(2)进入E中的气体是纯净、干燥的CO,氢氧化钠能与二氧化碳反应,能吸收二氧化碳;二氧化碳能使澄清石灰水浑浊,澄清石灰水可检验二氧化碳是否除尽;浓硫酸具有吸水性,可干燥气体,干燥气体须放在最后一步,所以B、C、D中的试剂依次是氢氧化钠溶液、澄清石灰水、浓硫酸,故填:cba;
(3)氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,所以装置C的主要作用是证明CO2气体被吸收完全或检验CO2是否除净;
(4)E装置中所发生的反应是在高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,化学方程式为: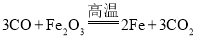 ;
;
(5)铁的氧化物与一氧化碳反应的化学方程式分别为:3CO+ Fe2O3![]() 2Fe + 3CO2,FeO+CO
2Fe + 3CO2,FeO+CO![]() Fe+CO2,Fe3O4+4CO
Fe+CO2,Fe3O4+4CO![]() 3Fe+4CO2,由反应的化学方程式可知,反应生成的二氧化碳中,氧元素一半来自于铁的氧化物,实验前后称得F装置增重7.7g就是二氧化碳的质量,因此铁红样品中氧元素质量为:
3Fe+4CO2,由反应的化学方程式可知,反应生成的二氧化碳中,氧元素一半来自于铁的氧化物,实验前后称得F装置增重7.7g就是二氧化碳的质量,因此铁红样品中氧元素质量为:![]() ,所以铁红中铁元素的质量分数=
,所以铁红中铁元素的质量分数=![]() ;
;
实验反思:
(1)碱石灰可以吸收空气中的二氧化碳和水,如果缺少G装置,F中吸收的二氧化碳质量增多,计算出的氧元素的质量增多,所以测得样品中铁的质量分数会偏小;
(2)一氧化碳有毒,扩散到空气中污染环境,所以本实验装置的一个明显缺陷是缺少尾气处理装置。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案【题目】人类的生产、生活离不开水和溶液。
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有_________作用。
(2)现有软水和硬水样品各一瓶,请设计实验对它们进行区分,并完成实验报告。
实验步骤 | 实验现象及结论 |
____ | ____ |
(3)下表是氯化钠、硝酸钾在不同温度时的溶解度。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | |
下列说法正确的是_________(填字母)。
A 氯化钠的溶解度大于硝酸钾的溶解度
B 20℃时,将30g氯化钠加入50 g水中,充分搅拌,所得溶液中溶质的质量分数为37.5%
C 分别将80℃时硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大
D 从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法
(4)下图是一定溶质质量分数的氯化钠溶液的配制流程。
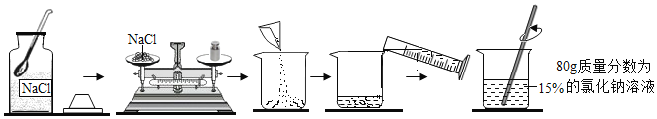
①实验步骤依次为:_________、称量、量取、溶解。用量筒量取所需的水时,若采用仰视的方法读数,配制的氯化钠溶液中溶质的质量分数会_________(填“偏大”或“偏小”)。
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为_________。
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是_______________________。