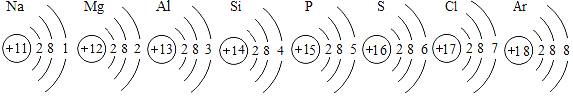
题目内容
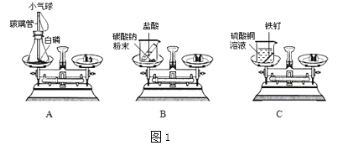
【题目】A、B、C、D四个烧杯中分别盛有质量相等的水,在相同的温度下,向四个烧杯中分别加入200g、150g、100g、50g的硝酸钾,充分溶解后,现象如图所示。请回答:
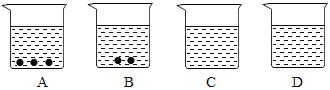
(1)烧杯_____________(填字母)中盛放的一定是不饱和溶液。
(2)四个烧杯中溶液的溶质质量分数由小到大的顺序是____________。
(3)为使烧杯A中的固体物质继续溶解,可选择的方法是___________(写一条即可)。
(4)某固体在溶解过程中,用手触摸烧杯外壁,感觉发烫,该固体可能是_________(填序号)。
①氢氧化钠 ②氯化钠 ③硝酸铵 ④面粉
【答案】D D<C<B=A,或D<C=A=B 加水 ①
【解析】
(1)AB中都含有固体溶质,因此都是饱和溶液,C中没有固体溶质,可能是饱和溶液,也可能是不饱和溶液,D中盛的一定是不饱和溶液。
故填:D;
(2)D中的溶质质量小于C中的溶质质量,因此C的溶质质量分数大于D中的溶质质量分数;
如果C是饱和溶液,则ABC中的溶质质量分数相等;
如果C是不饱和溶液,ABC中的溶质质量分数关系是C<B=A,因此四个烧杯中溶液的溶质质量分数由小到大的顺序是:D<C<B=A,或D<C=A=B;
故填:D<C<B=A,或D<C=A=B;
(3)为使烧杯A中的固体物质继续溶解,可选择的方法是继续加入水或升高温度。故填:加水;
(4)氢氧化钠溶于水放热,水的温度升高,氯化钠和面粉溶于水温度变化不明显,硝酸铵溶于水温度降低,故填:①。

【题目】(调查与研究)化学魔法课堂社团成员来到某电镀厂附近(工厂使用的燃料主要是煤),开展下列实验活动:取刚降到地面的雨水水样,用pH计每隔几分钟测一次pH,其数据如下表所示:
测定时刻 | 5:05 | 5:11 | 5:15 | 5:20 | 5:25 | 5:30 |
pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
①根据表格中的数据,请绘制出时间-pH关系图_______。
②根据雨水的pH及其变化情况,判断本地区是否酸雨?_______(填“是”或“否”)。雨水的酸性在______(填“增强”或“减弱”)。
③社团同学分析造成这一现象的原因是大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
(提出问题)通过实验证明煤中含有碳元素和硫元素。
(查阅资料)
(1)二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色)。
(2)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
(实验探究)
(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验:
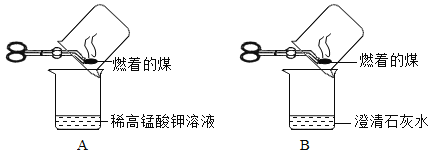
“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:___________。
(5)丙同学:
“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):

“现象与结论”
现象 | 结论 | |
B | ________ | 煤中含有硫元素 |
C | 无明显现象 | |
D | ________ | 煤中含有碳元素 |
上图C装置的作用是________________。
(6)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比)与温度、烟气中SO2浓度的关系,他们进行了探究实验。实验结果如下:
实验序号 | 温度/℃ | 烟气中SO2浓度/10-2g·L-1 | 脱硫率/% |
I | 23 | 2.5 | 99.5 |
II | 23 | 3.2 | 97.1 |
III | 40 | 2.5 | 94.3 |
由表中实验数据可得出的结论是______________;________________。
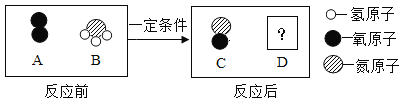
目前,科学家正在研究在一定条件下将乙烯(C2H4)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:O2与Cu+反应生成Cu+(O2);
第二步:Cu+(O2)与SO反应生成Cu+(SO3)2;
第三步:Cu+(SO3)2与C2H4反应生成S、CO2、H2O和Cu+。
除去二氧化硫的总反应的化学方程式是_________________。