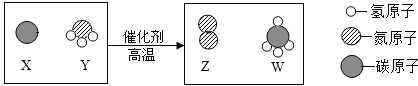
题目内容
【题目】某课外活动小组的同学查阅资料得知,传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐.该小组的同学将这三种物质混合后加入适量的水搅拌、过滤得滤渣和滤液,并对料浆澄清液(“滤液”)的主要成分进行探究.
(提出问题)滤液的主要成分(H2O除外)是什么?
(关于滤液的猜想)
小东认为:滤液中含有NaCl、Na2CO3、Ca(OH)2
小西认为:滤液中含有NaCl、NaOH、Na2CO3
小南认为:滤液中含有NaCl、NaOH、Ca(OH)2
小北认为:滤液中含有NaCl、NaOH
(1)大家讨论后一致认为___的猜想一定不成立,理由是__(用化学方程式表示).
(设计实验探究)
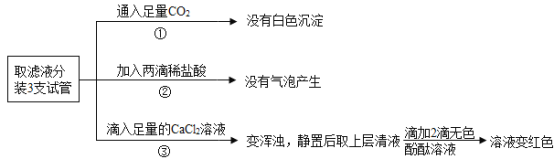
(2)根据实验①可知___的猜想不成立,根据实验③可知___的猜想成立,通过实验②无法判断小西的猜想能否成立,理由是__.
(应用拓展)
(3)松花蛋味道鲜美,直接食用稍有涩味.将松花蛋蘸食醋食用,则味道更为可口.请你说明食醋去除涩味的原因__.
(4)松花蛋生产中可用烧碱(NaOH)代替生石灰和纯碱.烧碱要密封保存,理由是__(填序号).
A 烧碱易吸水潮解且能吸收空气中的二氧化碳而变质
B 烧碱溶于水时放出热量
C 烧碱具有强腐蚀性
(5)假设小西的猜想是合理的,如何检验溶液中含有碳酸钠,操作及判断方法为:________.
【答案】小东 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 小南 小西 小西盐酸的量太少,无法确定Na2CO3(溶液)是否存在 食醋中的酸(或醋酸)中和残留在皮蛋中的碱 AB 取少量水样于试管中,加入足量稀盐酸,若产生能使澄清石灰水变浑浊的气体,则说明该溶液中含有碳酸钠
【解析】
(1)本题通过实验资料和实验分析,一致认为小东的猜想一定不成立,理由是碳酸钠与氢氧化钙不能共存,二者会反应生成氢氧化钠和碳酸钙沉淀;故答案为:小东;Na2CO3+Ca(OH)2═2NaOH+CaCO3↓。
(2)由流程图可知:通入二氧化碳气体,没有白色沉淀,说明没有氢氧化钙,因此小楠的猜想不成立;通过实验②无法判断小西的猜想能否成立,理由是:盐酸的量太少,无法确定Na2CO3(溶液)是否存在;通过实验③加入足量的氯化钙溶液,有白色沉淀,说明有碳酸钠;静止后加入酚酞试液变红色,说明一定有氢氧化钠,因此小西的猜想是正确的;故答案为:小南;小西;盐酸的量太少,无法确定Na2CO3(溶液)是否存在。
(3)食醋可以去除松花皮蛋涩味的原因是:食醋中的酸(或醋酸)中和残留在皮蛋中的碱;故答案为:食醋中的酸(或醋酸)中和残留在皮蛋中的碱。
(4)烧碱一定要密封保存,其理由是:烧碱易吸水潮解,烧碱易吸收空气中的CO2而变质;故答案为:AB。
(5)小西的猜想是滤液中含有NaCl、NaOH、Na2CO3,只用稀盐酸对废水进行处理,回收氯化钠溶液,操作及判断反应完全的方法为:边滴加稀盐酸边搅拌,至恰好不再有气泡冒出;故答案为:边滴加稀盐酸边搅拌,至恰好不再有气泡冒出。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末.在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是:___________________________,发生的反应方程式是:__________________________.
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究.
提出问题:什么导致溶液先变红再褪色?
猜想与假设:
猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”.
实验与结论:
a:甲同学提出的猜想,立即遭到其他同学的反对,因为______________________________;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
实验步骤 | 实验现象 | 实验结论 |
取少量稀氢氧化钠溶液于试管中,滴加1﹣2滴酚酞试液,变红后,___________观察现象 | 溶液依然为红色 | ____________________ |
讨论交流:你还能提出不同的猜想吗?如果还能提出新的合理的假设和方案你将获得奖励分4分.
猜想3:_____________
方案3:
实验步骤 | 实验现象 | 实验结论 |
_________________ | _______________ | ______________ |