题目内容
137、石灰水中含有的碱是
氢氧化钙
,俗称熟石灰
、消石灰
.氢氧化钠俗称火碱
、烧碱
、苛性钠
.NaOH易
溶于水,溶解时放
热,在空气中易
吸收水蒸气而潮解
.利用NaOH的吸水性可用做干燥剂
,可以干燥碱性
气体,如氨气
,不可以干燥酸性
气体,如二氧化碳
.氨水是一种挥发性较强的
碱,化学式为NH3?H2O
.分析:认识三种常见的碱,知道常见碱的俗称,其中氢氧化钠易溶于水且能吸收空气中水而潮解,通常用做干燥剂,但因其为碱能与酸性非金属氧化物发生反应,所以不能用来干燥此类气体.
解答:答:氢氧化钙溶液俗称为石灰水,氢氧化钙固体又被称为熟石灰、消石灰;
具有强腐蚀性的氢氧化钠被俗称为火碱、烧碱、苛性钠,易溶于水,溶解时放出大量热;氢氧化钠还能吸收空气中的水,在其表面形成溶液,这一过程称为潮解,因此氢氧化钠常被用作干燥剂,但不能用于干燥二氧化碳等类的酸性非金属氧化物气体,可以用来干燥氨气类碱性气体;
氨气极易溶于水,其水溶液称为氨水,具有较强的挥发性,其化学式写作NH3?H2O或;NH4OH;
故答:氢氧化钙,熟石灰,消石灰;火碱,烧碱,苛性钠,易,放,易,潮解,干燥剂,碱性,氨气,酸性,二氧化碳;
挥发性较强,NH3?H2O.
具有强腐蚀性的氢氧化钠被俗称为火碱、烧碱、苛性钠,易溶于水,溶解时放出大量热;氢氧化钠还能吸收空气中的水,在其表面形成溶液,这一过程称为潮解,因此氢氧化钠常被用作干燥剂,但不能用于干燥二氧化碳等类的酸性非金属氧化物气体,可以用来干燥氨气类碱性气体;
氨气极易溶于水,其水溶液称为氨水,具有较强的挥发性,其化学式写作NH3?H2O或;NH4OH;
故答:氢氧化钙,熟石灰,消石灰;火碱,烧碱,苛性钠,易,放,易,潮解,干燥剂,碱性,氨气,酸性,二氧化碳;
挥发性较强,NH3?H2O.
点评:氢氧化钠既能吸收空气中水分而潮解,又能与空气中二氧化碳生成碳酸钠而变质,因此保存氢氧化钠时要密封保存.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
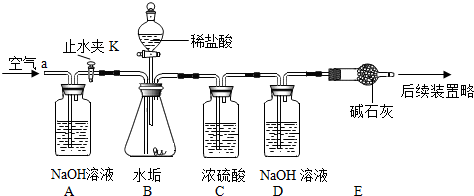
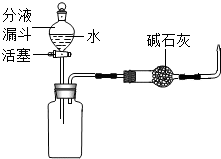 水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分.请你与他们一起完成如下的探究:
水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分.请你与他们一起完成如下的探究:
 23、①一双善于发现问题的眼睛能够带来许多意想不到的知识.
23、①一双善于发现问题的眼睛能够带来许多意想不到的知识.