题目内容
【题目】某化学活动小组探究金属的反应规律.在室温条件下进行如图所示实验. 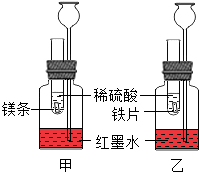
(1)已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应的方程式为 .
(2)若比较镁和铁的金属活动性,观察到的现象是;
(3)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 .
(4)若实验所用的金属均过量,则甲装置中产生的H2的质量(填“大于”、“小于”或“等于”)乙装置中产生的H2质量.
【答案】
(1)Mg+H2SO4=MgSO4+H2↑
(2)镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快
(3)因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快
(4)等于
【解析】解:(1)试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应的方程式为:Mg+H2SO4=MgSO4+H2↑,(2)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.(3)如图1所示实验的目的是:比较镁、铁分别与盐酸反应放热速度;因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.(4)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.所以答案是:(1)Mg+H2SO4=MgSO4+H2↑;(2)镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.(3)因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.(4)等于.
【考点精析】根据题目的已知条件,利用金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号.