题目内容
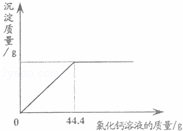
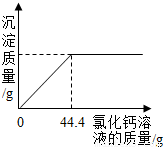
超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题:(1)该纯碱样品中碳酸钠的质量分数是多少?(写出计算步骤,计算记过精确到0.1%)
(2)至恰好完全反应时,所得不饱和溶液中溶质的质量分数为______(计算结果精确到0.1%)
(3)如果反应开始前,向烧杯中滴加几滴酚酞试液,在整个测定过程中可观察到的现象是:______.
【答案】分析:(1)欲求该纯碱样品中碳酸钠的质量分数,须先根据化学方程式求出样品中碳酸钠的质量,再利用质量分数公式计算即可.
(2)先根据化学方程式求出生成的氯化钠的质量,用5g减去碳酸钠的质量,计算出原来的氯化钠的质量.把生成的氯化钠的质量加上原来的氯化钠的质量,就是反应后溶质的质量,再根据溶质质量分数的计算公式进行计算即可;
(3)由于碳酸钠溶液显碱性,能使酚酞试液变红,反应后溶液变为中性,再进行分析即可.
解答:解:设该纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为Y,生成沉淀的质量为z,参加反应的氯化钙的质量为:44.4g×10%=4.44g则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
x 4.44g z y
根据: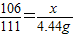 解得x=4.24g,根据:
解得x=4.24g,根据: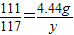 解得y=4.68g;根据:
解得y=4.68g;根据: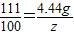 解得z=4g
解得z=4g
(1)该纯碱样品中碳酸钠的质量分数为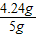 ×100%=84.8%;
×100%=84.8%;
(2)反应后不饱和溶液中溶质的质量为:5g-4.24g+4.68g=5.44g,反应后总溶液质量为:60g+44.4g-4g=100.4g,恰好完全反应时,所得不饱和溶液中溶质的质量分数为: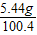 ×100%=5.4%;
×100%=5.4%;
(3)碳酸钠溶液显碱性,能使酚酞试液变红,反应后溶液变为中性,红色变为无色.
故答案为:(1)84.8%;(2)5.4%;(3)溶液先变红再变为无色.
点评:该考点的命题方向主要是通过创设相关问题情景或图表信息等,来考查学生对根据化学反应方程式的计算步骤和格式的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力.并且,经常将其与“书写化学方程式、相对分子质量的计算、化学符号及其周围数字的意义、元素符号和化学式的意义、质量守恒定律及其应用、化学方程式的读法和含义、常见化学反应中的质量关系、溶液中溶质质量分数的有关计算、含杂质物质的化学反应的有关计算”等相关知识联系起来,进行综合考查.
(2)先根据化学方程式求出生成的氯化钠的质量,用5g减去碳酸钠的质量,计算出原来的氯化钠的质量.把生成的氯化钠的质量加上原来的氯化钠的质量,就是反应后溶质的质量,再根据溶质质量分数的计算公式进行计算即可;
(3)由于碳酸钠溶液显碱性,能使酚酞试液变红,反应后溶液变为中性,再进行分析即可.
解答:解:设该纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为Y,生成沉淀的质量为z,参加反应的氯化钙的质量为:44.4g×10%=4.44g则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
x 4.44g z y
根据:
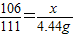 解得x=4.24g,根据:
解得x=4.24g,根据: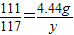 解得y=4.68g;根据:
解得y=4.68g;根据: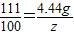 解得z=4g
解得z=4g(1)该纯碱样品中碳酸钠的质量分数为
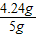 ×100%=84.8%;
×100%=84.8%;(2)反应后不饱和溶液中溶质的质量为:5g-4.24g+4.68g=5.44g,反应后总溶液质量为:60g+44.4g-4g=100.4g,恰好完全反应时,所得不饱和溶液中溶质的质量分数为:
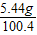 ×100%=5.4%;
×100%=5.4%;(3)碳酸钠溶液显碱性,能使酚酞试液变红,反应后溶液变为中性,红色变为无色.
故答案为:(1)84.8%;(2)5.4%;(3)溶液先变红再变为无色.
点评:该考点的命题方向主要是通过创设相关问题情景或图表信息等,来考查学生对根据化学反应方程式的计算步骤和格式的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力.并且,经常将其与“书写化学方程式、相对分子质量的计算、化学符号及其周围数字的意义、元素符号和化学式的意义、质量守恒定律及其应用、化学方程式的读法和含义、常见化学反应中的质量关系、溶液中溶质质量分数的有关计算、含杂质物质的化学反应的有关计算”等相关知识联系起来,进行综合考查.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
某化工厂用氨碱法生产的纯碱产品中含有少量的氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,在把100g稀盐酸平均分成四份依次放入样品中,每次均充分反应,实验数据记录如下:
请你据此分析计算:
(1)第一次加入盐酸充分反应后,生成二氧化碳的质量是 g.
(2)该产品中碳酸钠的质量分数是否合格?(写出计算过程,结果精确到0.1%)
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量/g | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
(1)第一次加入盐酸充分反应后,生成二氧化碳的质量是
(2)该产品中碳酸钠的质量分数是否合格?(写出计算过程,结果精确到0.1%)
 (2013?青岛)超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题:
(2013?青岛)超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题: 超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题:
超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题: