题目内容
将某氯化镁和氯化钡的混合物10g加水配制成50g溶液,该溶液恰好与50g硫酸镁溶液完全反应,过滤后得到4.66g沉淀.求:(计算结果保留三个有效数字)
(1)原混合物中氯化镁的质量;
(2)求滤液中溶质的质量分数.
解:设参加反应氯化钡的质量为x,生成氯化镁的质量为y.
BaCl2+MgSO4=BaSO4↓+MgCl2
208 233 95
x 4.66g y
∴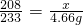 ,
,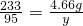
解之得:x=4.16g,y=1.9g,
原混合物中氯化镁的质量为:10g-4.16g=5.84g,所以溶液中氯化镁的总质量为5.84g+1.9g=7.74g,
溶质的质量分数=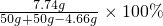 ≈8.12%,
≈8.12%,
答:原混合物中氯化镁的质量为5.84g,滤液中溶质的质量分数为8.12%.
分析:(1)因为氯化镁和硫酸镁不能互换成分,故不反应,那么就只有混合物中氯化钡和硫酸镁溶液发生反应.根据化学方程式计算出参与反应的氯化钡的质量,就可用混合物的质量减去氯化钡的质量求出原混合物中氯化镁的质量;
(2)完全反应后,溶液中的溶质是氯化镁,它包括混合物中的氯化镁的质量和生成物中氯化镁的质量.根据化学方程式计算出生成的氯化镁的质量,然后根据溶质质量分数公式计算即可.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.
BaCl2+MgSO4=BaSO4↓+MgCl2
208 233 95
x 4.66g y
∴
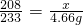 ,
,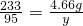
解之得:x=4.16g,y=1.9g,
原混合物中氯化镁的质量为:10g-4.16g=5.84g,所以溶液中氯化镁的总质量为5.84g+1.9g=7.74g,
溶质的质量分数=
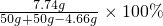 ≈8.12%,
≈8.12%,答:原混合物中氯化镁的质量为5.84g,滤液中溶质的质量分数为8.12%.
分析:(1)因为氯化镁和硫酸镁不能互换成分,故不反应,那么就只有混合物中氯化钡和硫酸镁溶液发生反应.根据化学方程式计算出参与反应的氯化钡的质量,就可用混合物的质量减去氯化钡的质量求出原混合物中氯化镁的质量;
(2)完全反应后,溶液中的溶质是氯化镁,它包括混合物中的氯化镁的质量和生成物中氯化镁的质量.根据化学方程式计算出生成的氯化镁的质量,然后根据溶质质量分数公式计算即可.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目