题目内容
根据如图所示的四个实验,回答下列问题。
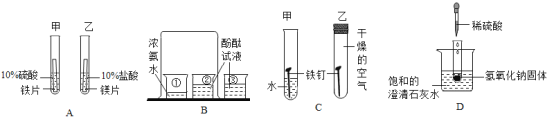
(1)实验A中从乙试管中产生气泡速率大于甲试管中产生气泡速率,是否能说明金属活动性:镁>铁_____(填“是”或“否”)。
(2)B实验中烧杯③的作用是_____。
(3)从C中甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明铁生锈需要的条件_____。
(4)D图中向盛有NaOH固体的试管中滴加稀硫酸,能观察到_____的现象。
用砂纸打磨过的镁条加入盛有稀盐酸的试管中,产生大量气泡,且试管发热。在分组实验中,部分小组的同学发现:试管中出现白色不溶物。
(1)请你写出镁条与稀盐酸反应的化学方程式_____。
(提出问题一)为什么有的小组会出现白色不溶物?
(实验探究一)在4支试管中分别加入相同质量、相同溶质质量分数的稀盐酸,形状大小相同、用砂纸打磨过的镁条,实验记录如表:
试管 | A | B | C | D |
镁条的长度/cm | 1 | 2 | 3 | 4 |
不溶物 | 无 | 少量 | 较多 | 很多 |
(实验结论)通过上表可知,出现白色不溶物与_____有关。
(2)(提出问题二)白色不溶物是什么?
(查阅资料)
①AgNO3与可溶性氯化物反应,生成不溶于水,也不与稀硝酸反应的白色沉淀。
②Mg(OH)2和Mg(OH)Cl均为白色固体,不溶于水但能与稀盐酸、稀硫酸等反应生成盐和水。
(提出猜想)
猜想1:是没有参加反应的镁条;
猜想2:是生成的MgCl2过多而析出晶体
猜想3:是生成的Mg(OH)2白色沉淀;
猜想4:是生成的 Mg(OH)Cl白色沉淀。
(实验探究二)
将上述(实验探究一)D试管反应后的物质过滤,并将得到的白色不溶物分成三份,分别放入三支试管中进行实验。
实验序号 | 实验操作 | 实验现象 | 实验结论 |
实验1 | 滴加适量_____ | 白色不溶物消失,无气体产生 | 猜想1不成立 |
实验2 | 加入适量蒸馏水,充充分振荡 | 白色不溶物没有减少; | 猜想2_____(“成立”或“不成立”) |
实验3 | ①滴入足量的稀硝酸 ②再向①中继续滴入足量的硝酸银溶液 | ①_____; ②_____。 | 白色不溶物一定含有氯元素,说明猜想3不成立,猜想4成立 |
(实验反思)
①甲同学对上述实验3的结论提出质疑,他认为实验3设计不严密,要验证猜想4是否成立,在进行实验3之前应该进行的操作是_____。
②在老师的指导下,实验小组最终确定白色不溶物是Mg(OH)Cl,请写出Mg(OH)Cl与稀盐酸反应的化学方程式_____。
除去下列物质所含少量杂质的方法正确的是( )
选项 | 物质 | 所含杂质 | 除去杂质的方法 |
A | NaOH | Na2CO3 | 加入稀盐酸至不再产生气泡 |
B | Cu粉 | C | 在空气中灼烧 |
C | CuSO4溶液 | FeSO4 | 加足量铜粉,过滤 |
D | CaCl2溶液 | HCl | 加过量CaCO3粉末,过滤 |
A. A B. B C. C D. D