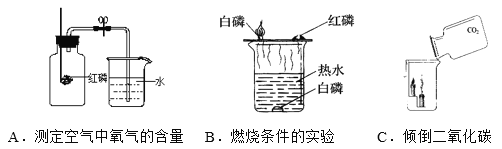
题目内容
【题目】某研究性学习小组为验证“氨气还原氧化铜”的实验,认真查阅资料并做出以下准备。
资料准备:
I.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
Ⅱ.氨气在加热的条件下还原氧化铜,有三种生成物:一是金属单质,二是空气中含量最多的气体,三是相对分子质量最小的氧化物。
实验准备:
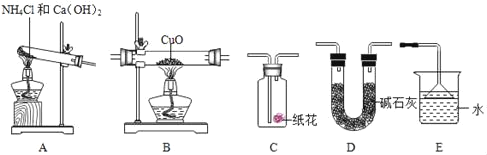
请回答:
(1)为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序_____(填序号)。
(2)装置A中发生反应的化学方程式_____。
(3)装置B观察到的现象_____,其反应的化学方程式为_____;装置E的作用_____。
(4)若将装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变_____色。
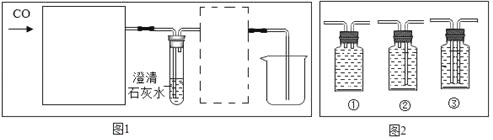
(5)若实验室用一氧化碳还原氧化铜,应选上述装置_____(填序号)与下列图1中的_____装置连接,则该装置玻璃管内发生反应的化学方程式是_____,实验时要先通CO再加热的目的是防止一氧化碳和空气混合加热时发生爆炸。图1虚线框内的装置是用于吸收CO2,并收集CO,应选择图2(广口瓶内均为氢氧化钠溶液)中的装置_____(填序号)最合适。
【答案】A.D.B.D.E Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑ 黑色氧化铜逐渐变成红色 2NH3+3CuO
CaCl2+2H2O+2NH3↑ 黑色氧化铜逐渐变成红色 2NH3+3CuO![]() 3Cu+N2+3H2O 吸收氨气,防止污染环境 蓝 B 澄清石灰水 CuO+CO
3Cu+N2+3H2O 吸收氨气,防止污染环境 蓝 B 澄清石灰水 CuO+CO![]() Cu+CO2 ③
Cu+CO2 ③
【解析】
(1)氢氧化钙和氯化铵在加热的条件下生成氯化钙、水和氨气,反应后有水生成,故要用D装置吸收水,碱石灰具有吸水性,氨气和氧化铜在加热的条件下生成铜、水和氮气,需要用D装置验证有水生成,氨气有刺激性气味,易溶于水形成氨水,需要尾气处理,所以装置A.B.D.E的正确连接顺序是:A.D.B.D.E;
(2)氢氧化钙和氯化铵在加热的条件下生成氯化钙、水和氨气,化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3)氨气和氧化铜在加热的条件下生成铜、水和氮气,所以装置B观察到的现象是:黑色氧化铜逐渐变成红色,化学方程式为:2NH3+3CuO![]() 3Cu+N2+3H2O;氨气有刺激性气味,污染空气,需要尾气处理,故装置E的作用是:吸收氨气,防止污染环境;
3Cu+N2+3H2O;氨气有刺激性气味,污染空气,需要尾气处理,故装置E的作用是:吸收氨气,防止污染环境;
(4)氨气溶于水形成氨水,氨水显碱性,能使紫色石蕊变蓝色;
(5)氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,二氧化碳能使澄清石灰水变浑浊,一氧化碳有毒,需要尾气处理,所以实验室用一氧化碳还原氧化铜,应选上述装置B与下列图1中的澄清石灰水装置连接,玻璃管内发生反应的化学方程式是:CuO+CO![]() Cu+CO2,实验时要先通CO再加热的目的是防止一氧化碳和空气混合加热时发生爆炸。图1虚线框内的装置是用于吸收CO2,并收集CO,应选择图2中的装置③最合适。
Cu+CO2,实验时要先通CO再加热的目的是防止一氧化碳和空气混合加热时发生爆炸。图1虚线框内的装置是用于吸收CO2,并收集CO,应选择图2中的装置③最合适。

 特高级教师点拨系列答案
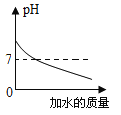
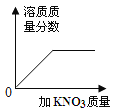
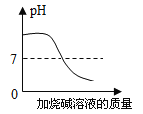
特高级教师点拨系列答案【题目】下列图像表述的化学事实与实际相符的是
A | B | C | D | |
图象 |
|
|
|
|
实验或事实 | 向pH=12的Ca(OH)2溶液中不断加水稀释 | 20C时,向一杯不饱和的KNO3溶液中逐步加入KNO3晶体 | 向稀盐酸中滴加过量的烧碱溶液 | 将一定质量的MnO2和KClO混合加热 |
A. AB. BC. CD. D