题目内容
(2002?新疆)将6.2克氧化钠粉末投入43.8克水中,完全溶解后,计算所得溶液中溶质的质量分数.
分析:由于氧化钠能够和水发生化学反应,因此所得溶液中的溶质是生成的氢氧化钠,由于在反应的过程中并没有沉淀和气体生成,因此溶液的质量则为氧化钠和水的质量总和;最后根据溶质质量分数=
×100%即可求得所得溶液中溶质的质量分数.
| 溶质质量 |
| 溶液质量 |
解答:解:溶解后溶质是NaOH,设生成NaOH的质量为x;
Na2O+H2O=2NaOH
62 40×2
6.2g x
=
,
x=
=8g;
则NaOH的质量分数=
×100%=16%;
答:所得溶液中溶质的质量分数是16%.
Na2O+H2O=2NaOH
62 40×2
6.2g x
| 62 |
| 6.2g |
| 40×2 |
| x |
x=
| 80×6.2g |
| 62 |
则NaOH的质量分数=
| 8g |
| 6.2g+43.8g |
答:所得溶液中溶质的质量分数是16%.
点评:本题难度较大,主要考查了有关化学方程式的溶液中溶质的质量分数的计算,培养学生的综合应用能力;关键是要知道溶液的溶质是谁.

练习册系列答案
相关题目
 (2002?新疆)甲、乙两位同学均用图所示的装置制取气体,此装置由大小两个试管相套组成,其中小试管为气体发生器,大试管为气体收集装置.甲同学用此装置制取H2,乙同学用此装置制取CO2,当反应完毕后,都将大试管向上抽出,并用拇指堵住试管口.请回答:
(2002?新疆)甲、乙两位同学均用图所示的装置制取气体,此装置由大小两个试管相套组成,其中小试管为气体发生器,大试管为气体收集装置.甲同学用此装置制取H2,乙同学用此装置制取CO2,当反应完毕后,都将大试管向上抽出,并用拇指堵住试管口.请回答: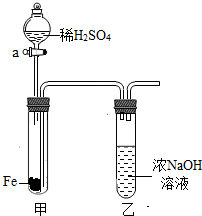 (2002?新疆)如图所示,甲试管中事先放入一定量的铁片,漏斗中盛有稀H2SO4,乙试管中盛有浓溶液.
(2002?新疆)如图所示,甲试管中事先放入一定量的铁片,漏斗中盛有稀H2SO4,乙试管中盛有浓溶液.