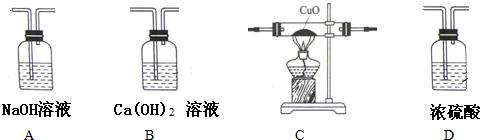
题目内容
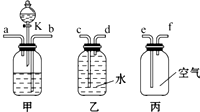 现有CO和CO2组成的混合气体,为了将它们分开,得到较纯净的CO和CO2,某中学课题研究小组设计了如图所示的实验装置(甲为分离装置,乙和丙为收集装置),其中所用的化学试剂可能为:①饱和石灰水;②稀硫酸;③稀盐酸.(CO的密度比空气略小,且难溶于水)
现有CO和CO2组成的混合气体,为了将它们分开,得到较纯净的CO和CO2,某中学课题研究小组设计了如图所示的实验装置(甲为分离装置,乙和丙为收集装置),其中所用的化学试剂可能为:①饱和石灰水;②稀硫酸;③稀盐酸.(CO的密度比空气略小,且难溶于水)(1)甲图中广口瓶内应装的药品是
①
①
,分液漏斗中的药品是③
③
(填序号).(2)实验时,混合气体应从甲装置导气管
b
b
端通入,从导气管a
a
端逸出,逸出的气体是CO
CO
,广口瓶里发生反应的化学方程式是:CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.(3)混合气体通入完毕后,再打开分液漏斗的开关阀门K,使漏斗中的药品流入广口瓶里,这时发生的反应是
CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
,此时逸出的气体是CO2
CO2
.(4)若要把甲装置逸出的CO收集起来,应选用
乙
乙
装置,CO应从该装置中导气管d
d
口进入,若要把甲装置逸出的CO2收集起来,应选用丙
丙
装置,CO2应从该装置中导气管f
f
口进入.分析:根据CO2最常见的性质能与碱反应生成碳酸盐,可以先将CO2暂时除去,而CO一般不与任何物质反应且难溶于水,所以可以先分离出CO;然后将变成的碳酸盐加入适量稀酸再变回成CO2,则达到实验的目对CO2和CO混合气体分离.
解答:解:(1)二氧化碳能和石灰水反应生成碳酸钙和水,盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,所以甲图中广口瓶内应装的药品是饱和石灰水,分液漏斗中的药品是稀盐酸;故填:①;③;
(2)根据气体混合物中物质的特性首先分离出来的是CO(难溶于水又不与其他物质反应),那么应关闭K让混合气体通过甲中试剂除去CO2,所以混合气体应从甲装置导气管b端通入,从导气管a端逸出,逸出的气体是一氧化碳,广口瓶里发生反应是二氧化碳和石灰水反应生成碳酸钙沉淀和水,反应的化学方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;故填:b;a;CO;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)混合气体通入完毕后,再打开分液漏斗的开关阀门K,使漏斗中的药品流入广口瓶里,这时发生的反应是盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式是:CaCO3+2HCl═CaCl2+CO2↑+H2O;此时逸出的气体是二氧化碳;故填:CaCO3+2HCl═CaCl2+CO2↑+H2O;CO2;
(4)CO的密度比空气略小,且难溶于水,所以若要把甲装置逸出的CO收集起来,应选用排水法收集,一氧化碳的密度比水小,所以CO应从该装置中导气管d口进入,二氧化碳能溶于水,所以若要把甲装置逸出的CO2收集起来,应选用排空气法,二氧化碳的密度大于空气的密度,所以CO2应从该装置中导气管f口进入.故填:乙;d;丙;f.
(2)根据气体混合物中物质的特性首先分离出来的是CO(难溶于水又不与其他物质反应),那么应关闭K让混合气体通过甲中试剂除去CO2,所以混合气体应从甲装置导气管b端通入,从导气管a端逸出,逸出的气体是一氧化碳,广口瓶里发生反应是二氧化碳和石灰水反应生成碳酸钙沉淀和水,反应的化学方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;故填:b;a;CO;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)混合气体通入完毕后,再打开分液漏斗的开关阀门K,使漏斗中的药品流入广口瓶里,这时发生的反应是盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式是:CaCO3+2HCl═CaCl2+CO2↑+H2O;此时逸出的气体是二氧化碳;故填:CaCO3+2HCl═CaCl2+CO2↑+H2O;CO2;
(4)CO的密度比空气略小,且难溶于水,所以若要把甲装置逸出的CO收集起来,应选用排水法收集,一氧化碳的密度比水小,所以CO应从该装置中导气管d口进入,二氧化碳能溶于水,所以若要把甲装置逸出的CO2收集起来,应选用排空气法,二氧化碳的密度大于空气的密度,所以CO2应从该装置中导气管f口进入.故填:乙;d;丙;f.
点评:本题考查了气体混合物分离过程,混合物的分离是指用物理、化学方法将混合物中各组分分开,并恢复到原状态,得到比较纯的物质.本题是气体与气体的混合物常用洗气吸收法.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目