题目内容
(2009?厦门)阅读材料,回答问题:材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(如表是其片
| 13 Al 铝 26.98 | 14 Si 硅 28.09 |
| 类铝 | 类硅 |
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g?cm-3之间.
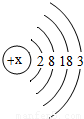
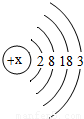
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图,常见化合价为+3.
(1)镓元素的质子数为______,其原子最外层电子数为______;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:______;
化学性质(请用化学方程式表示):______ 2Ga(OH)3+3H2↑
【答案】分析:(1)根据在原子中,质子数=核外电子数,进行解答;离原子核最远的是最外层,依据原子结构示意图即可解答;
(2)物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质;物质的化学性质包括可燃性、氧化性、还原性、稳定性、酸性、碱性、热解性等,通常描述的语句中有能、可以、可等字眼儿进行解答;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法即可写出化学式.
(4)根据元素周期表中的一个小格所提供的信息,进行解答;
(5)依据题意进行分析解答.
解答:解:(1)根据在原子中,质子数=核外电子数,由原子结构示意图可知镓元素原子的质子数为:31;
最外层电子数为:3;
(2)根据物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质,从题中可知
镓的物理性质为:镓是银白色金属,密度为5.94g?cm-3;
根据镓能与沸水剧烈反应生成氢气和氢氧化镓反应化学方程式为:2Ga+6H2O 2Ga(OH)3+3H2↑;
2Ga(OH)3+3H2↑;
根据目前金属镓广泛用于制造半导体材料,可知镓的用途为:制造半导体材料;
故答案为:银白色金属,密度为5.94g?cm-3; 2Ga+6H2O 2Ga(OH)3+3H2↑; 制造半导体材料;
2Ga(OH)3+3H2↑; 制造半导体材料;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法写出硫酸镓的化学式为:Ga2(SO4)3;
故答案为:Ga2(SO4)3 .
(4)根据元素周期表中的一个小格所提供的信息可知:相对原子质量(原子量)为28.09或质子数(原子序数、核电荷数)为14;故答案为:相对原子质量(原子量)为28.09 或 质子数(原子序数、核电荷数)为14;
(5)根据题意:镓能与沸水剧烈反应生成氢气和氢氧化镓,可推断:镓元素的发现应用了实验研究方法;
①考生能从两种以上化学研究方法进行说明即可:
如:化学研究方法有理论研究和实验研究
化学理论研究要得到实验研究的验证
化学实验研究为理论研究提供依据
化学理论研究为化学实验研究提供了方向
②考生能从一种化学方法或具体方法进行说明也可,
如:化学研究可以使用理论和推理的方法
化学研究可以使用实验的方法
元素周期表研究使用了理论(模型、猜想)的研究方法
镓元素的发现应用了实验研究方法.
点评:本题考查学生根据题中所给的信息及所学知识进行分析解题的能力,注意书写化学方程式的写配标等.
(2)物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质;物质的化学性质包括可燃性、氧化性、还原性、稳定性、酸性、碱性、热解性等,通常描述的语句中有能、可以、可等字眼儿进行解答;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法即可写出化学式.
(4)根据元素周期表中的一个小格所提供的信息,进行解答;
(5)依据题意进行分析解答.
解答:解:(1)根据在原子中,质子数=核外电子数,由原子结构示意图可知镓元素原子的质子数为:31;
最外层电子数为:3;
(2)根据物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质,从题中可知
镓的物理性质为:镓是银白色金属,密度为5.94g?cm-3;
根据镓能与沸水剧烈反应生成氢气和氢氧化镓反应化学方程式为:2Ga+6H2O
 2Ga(OH)3+3H2↑;
2Ga(OH)3+3H2↑;根据目前金属镓广泛用于制造半导体材料,可知镓的用途为:制造半导体材料;
故答案为:银白色金属,密度为5.94g?cm-3; 2Ga+6H2O
 2Ga(OH)3+3H2↑; 制造半导体材料;
2Ga(OH)3+3H2↑; 制造半导体材料;(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法写出硫酸镓的化学式为:Ga2(SO4)3;
故答案为:Ga2(SO4)3 .
(4)根据元素周期表中的一个小格所提供的信息可知:相对原子质量(原子量)为28.09或质子数(原子序数、核电荷数)为14;故答案为:相对原子质量(原子量)为28.09 或 质子数(原子序数、核电荷数)为14;
(5)根据题意:镓能与沸水剧烈反应生成氢气和氢氧化镓,可推断:镓元素的发现应用了实验研究方法;
①考生能从两种以上化学研究方法进行说明即可:
如:化学研究方法有理论研究和实验研究
化学理论研究要得到实验研究的验证
化学实验研究为理论研究提供依据
化学理论研究为化学实验研究提供了方向
②考生能从一种化学方法或具体方法进行说明也可,
如:化学研究可以使用理论和推理的方法
化学研究可以使用实验的方法
元素周期表研究使用了理论(模型、猜想)的研究方法
镓元素的发现应用了实验研究方法.
点评:本题考查学生根据题中所给的信息及所学知识进行分析解题的能力,注意书写化学方程式的写配标等.

练习册系列答案
相关题目
24.(2009?厦门)阅读材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(如表是其片
断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g?cm-3之间.
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图,常见化合价为+3.
(1)镓元素的质子数为______,其原子最外层电子数为______;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:______;
化学性质(请用化学方程式表示):______ 2Ga(OH)3+3H2↑
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(如表是其片
| 13 Al 铝 26.98 | 14 Si 硅 28.09 |
| 类铝 | 类硅 |
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g?cm-3之间.
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图,常见化合价为+3.
(1)镓元素的质子数为______,其原子最外层电子数为______;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:______;
化学性质(请用化学方程式表示):______ 2Ga(OH)3+3H2↑

 (2009?厦门)请按如图所示的硫酸知识网络填空(图中“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质):
(2009?厦门)请按如图所示的硫酸知识网络填空(图中“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质): (2008?厦门)阅读材料,回答问题:
(2008?厦门)阅读材料,回答问题: