题目内容
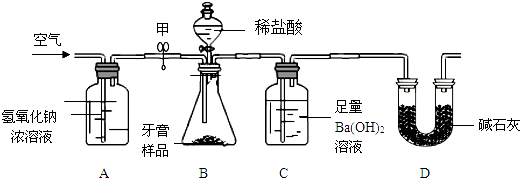
(2013?北京二模)某兴趣小组测纯碱样品中Na2CO3质量分数的实验过程和数据如图所示.(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl)

计算:
(1)该样品中Na2CO3的质量分数?
(2)最终所得溶液中溶质NaCl的质量分数?

计算:
(1)该样品中Na2CO3的质量分数?
(2)最终所得溶液中溶质NaCl的质量分数?
分析:解答本题关键是根据质量守恒定律:溶液质量的减少量是生成沉淀的质量,再根据沉淀的质量计算出碳酸钠的质量和生成的氯化钠的质量;用原来混合物的质量减去碳酸钠的质量就是原来的氯化钠的质量,再加上新生成的氯化钠质量,除以反应后溶液质量,乘以百分之百.
解答:解:设该样品中Na2CO3的质量为x,反应生成NaCl的质量为y
生成CaCO3的质量=22.3g+100.0g+86.1g-198.4g=10 g
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10 g y
根据:
=
解得x=10.6g 根据:
=
解得y=11.7g
样品中Na2CO3的质量分数=
×100%=47.5%
样品中NaCl的质量=22.3g-10.6g=11.7g
最终所得溶液中溶质NaCl的质量分数=
×100%=11.8%
答:样品中Na2CO3的质量分数为47.5%,最终所得溶液中溶质NaCl的质量分数为11.8%.
生成CaCO3的质量=22.3g+100.0g+86.1g-198.4g=10 g
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10 g y
根据:
| 106 |
| 100 |
| x |
| 10g |
| 100 |
| 117 |
| 10g |
| y |
样品中Na2CO3的质量分数=
| 10.6g |
| 22.3g |
样品中NaCl的质量=22.3g-10.6g=11.7g
最终所得溶液中溶质NaCl的质量分数=
| 11.7g+11.7g |
| 198.4g |
答:样品中Na2CO3的质量分数为47.5%,最终所得溶液中溶质NaCl的质量分数为11.8%.
点评:解答本题关键是要知道碳酸钙沉淀的质量计算方法,22.3g+100.0g+86.1g-198.4g=10 g,这是本题的突破口.

练习册系列答案
相关题目
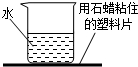 (2013?北京二模)某同学往右图所示的烧杯(用石蜡将烧杯和塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )
(2013?北京二模)某同学往右图所示的烧杯(用石蜡将烧杯和塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )