题目内容
在某公共场所,有如图广告:问:(1)、NH4NO3中氮元素质量分数______;该广告称“**化肥”中氮元素含量是______,因此,这是一则______(真/假)广告.
(2)每袋化肥中含氮元素多少千克(本体计算是以纯硝酸铵计算)?
(3)要向一块地里施加含7Kg氮元素的肥料,试计算需要多少千克硝酸铵?

【答案】分析:(1)根据硝酸铵的化学式及原子的相对原子质量来计算元素的质量分数,利用图中广告来分析化肥中氮元素的含量并判断广告的真实性;
(2)根据化肥的质量及氮元素的质量分数来计算每袋化肥中含氮元素的质量;
(3)根据氮元素的质量及硝酸铵中氮元素的质量分数来计算硝酸铵的质量.
解答:解:(1)由硝酸铵的化学式为NH4NO3,则氮元素的质量分数为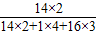 ×100%=35%,
×100%=35%,
因化肥的主要成分为硝酸铵,则广告中氮元素的质量分数为38.8%是指氮元素的质量与化肥的质量相比所得的质量分数,
若其它物质不含氮元素,则不可能大于35%,则属于假广告,
故答案为:35%;氮元素在化肥中的质量分数;假;
(2)由图可知,化肥50Kg,含氮元素的质量分数为35%,则每袋化肥中含氮元素为50Kg×35%=17.5Kg,
答:每袋化肥中含氮元素17.5千克;
(3)因硝酸铵中氮元素的质量分数为35%,氮元素的质量为7Kg,
则需要的硝酸铵的质量为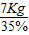 =20Kg,
=20Kg,
答:需要20Kg硝酸铵.
点评:本题考查学生利用信息中物质的化学式来进行简单计算,并利用计算来分析生活中广告的真实性,体现了学以致用的效果.
(2)根据化肥的质量及氮元素的质量分数来计算每袋化肥中含氮元素的质量;
(3)根据氮元素的质量及硝酸铵中氮元素的质量分数来计算硝酸铵的质量.
解答:解:(1)由硝酸铵的化学式为NH4NO3,则氮元素的质量分数为
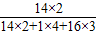 ×100%=35%,
×100%=35%,因化肥的主要成分为硝酸铵,则广告中氮元素的质量分数为38.8%是指氮元素的质量与化肥的质量相比所得的质量分数,
若其它物质不含氮元素,则不可能大于35%,则属于假广告,
故答案为:35%;氮元素在化肥中的质量分数;假;
(2)由图可知,化肥50Kg,含氮元素的质量分数为35%,则每袋化肥中含氮元素为50Kg×35%=17.5Kg,
答:每袋化肥中含氮元素17.5千克;
(3)因硝酸铵中氮元素的质量分数为35%,氮元素的质量为7Kg,
则需要的硝酸铵的质量为
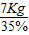 =20Kg,
=20Kg,答:需要20Kg硝酸铵.
点评:本题考查学生利用信息中物质的化学式来进行简单计算,并利用计算来分析生活中广告的真实性,体现了学以致用的效果.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目

 在某公共场所,有如图广告:
在某公共场所,有如图广告:

