题目内容
“多变的蜡烛”趣味实验。

①实验一中燃着的蜡烛会熄灭的是_____(填烧杯序号)。结合物质的性质和灭火的原理蜡烛熄灭的原因是_____。
②实验二中,若玻璃管太长,则不易观察到蜡蒸汽燃烧。其原因是_____。
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺,同学们查阅相关资料并进行模拟实验.
(查阅资料)
①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:
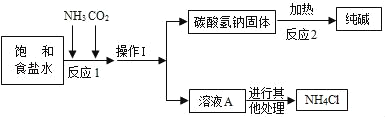
③氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
(理论分析)
(1)依据资料①可知相同条件下,NaHCO3的溶解度_____NH4Cl的溶解度(填“>”或“<”).
(2)NaHCO3受热分解制得纯碱及两种常见的氧化物,该反应的化学方程式是_____.
(模拟实验)验证侯氏制碱法能获得纯碱
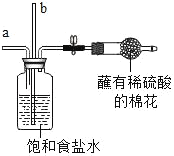
步骤 | 蘸有稀硫酸 实验装置 | 实验操作及现象 | 解释与结论 |
1 |
| 从a管通入NH3,一段时间后,从b管通入CO2,溶液中有固体析出 | (1)蘸有稀硫酸的棉花的作用是_____ (2)通NH3的a管若伸到液面下,会造成的后果是_____ |
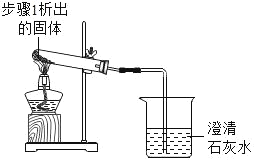
2 |
| 加热,导管口有气泡,澄清石灰水变浑浊 | 步骤1析出的固体是碳酸氢钠 |
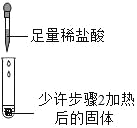
3 |
| 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |
(实验反思)同学们认为步骤3的结论存在不足.依据题中信息,设计实验确定步骤2加热后得到的固体成分,其方案是_____.
馒头、面包等发面食品在制作时都需使用发酵粉,发酵粉的主要成分最常见的是碳酸钠、碳酸氢钠等。某兴趣小组的同学对制作馒头用的发酵粉(白色粉末)进行探究。
(提出问题)白色粉末成分是什么?
(进行猜想)猜想Ⅰ:碳酸钠; 猜想Ⅱ:碳酸氢钠; 猜想Ⅲ:_____。
(初步探究)取少量白色粉末于试管中,加适量水,测得溶液的 pH=10.5,说明溶液呈_____性。
(查阅资料)
(1)碳酸氢钠受热易分解,该反应可表示为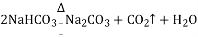 ;而碳酸钠很稳定,受热不易分解。
;而碳酸钠很稳定,受热不易分解。
(2)参照实验:
NaHCO3稀溶液 | Na2CO3稀溶液 | |
加入稀盐酸 | 产生气泡 | 产生气泡 |
加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 |
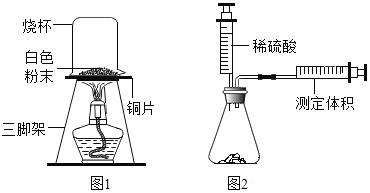
(实验探究)甲、乙、丙三位同学分别设计三种不同实验方案进行探究。
甲同学方案:如图,取适量发酵粉在铜片上加热,加热一段时间后,观察到烧杯内壁有液滴出现,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到_____。甲得出结论:猜想Ⅱ正确。
乙同学方案:
实验步骤 | 实验现象 | 实验结论 |
①取少量发酵粉加足量水后形成的无色稀溶液,再加入过量CaCl2溶液,静置。 | 有白色沉淀产生 | 化学方程式_____。 |
②再取步骤①的上层清液,加入稀盐酸 | 有气泡冒出 | 该溶液中含_____。 |
乙得出结论:猜想Ⅲ正确。
丙同学方案:用如图所示,锥形瓶中分别盛有等质量的碳酸钠、碳酸氢钠和发酵粉,再注入等体积、等浓度的足量的稀硫酸,准确测量生成气体的体积。记录如表:
实验 编号 | 锥形瓶内物质 | 最终得到 CO2 体积/mL | |
名称 | 质量/g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 发酵粉 | a | V3 |
(实验结论)经同学们讨论,最终确认:该发酵粉是碳酸钠和碳酸氢钠的混合物。
(反思应用)
(1)同学们讨论时认为:甲同学方案不严密的原因是_____。
(2)乙同学方案中,实验①中加入CaCl2溶液要过量的目的是_____。
(3)丙同学方案也能得到正确结论应满足的条件是_____。
(4)制作馒头、面包时,将面粉发酵(产生有机酸),再加入适量的碳酸氢钠,可以使馒头、面包松软。原因是_____。
(5)将12.0g该白色粉末加热至完全反应,剩余固体的质量为8.9g,计算该白色粉末中Na2CO3的质量分数为_____。