题目内容
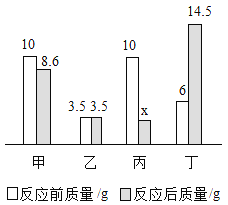
【题目】工业盐酸中通常溶有少量的FeCl3而呈黄色,小红进行了如下实验:取一定质量该工业盐酸,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请回答下列问题:
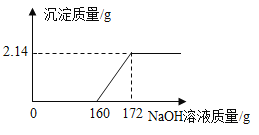
(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是 g。
(2)所用NaOH溶液的溶质质量分数是多少?
【答案】(1)2.14
(2)20%
【解析】
(1)盐酸与氢氧化钠反应不产生沉淀,氯化铁与盐酸反应产生沉淀,由图可知,纵坐标表示生成沉淀质量,最高点为FeCl3与NaOH恰好完全反应生成沉淀的质量为2.14g,故填写:2.14;
(2)由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g-160g=12g;
解:设消耗的氢氧化钠的质量为x

所用NaOH溶液的溶质质量分数是![]()
答:所用NaOH溶液的溶质质量分数是20%。

【题目】MgSO47H2O 是一种重要的化工原料,某工厂以一种镁矿石(主要成分为 SiO2和 MgCO3,还含有少量 FeCO3,其它成分忽略)为原料制备 MgSO47H2O 的主要流程如图:
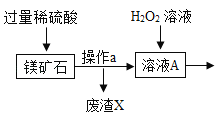
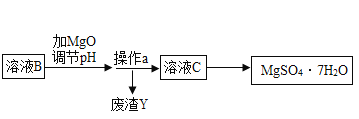
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的 pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的 pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3与稀硫酸发生反应的化学方程式为_________;为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 升高反应温度 C 用稀硫酸多次浸泡
(2)溶液 A中所含的溶质成分有_____;溶液 A中加入 H2O2溶液会生成 Fe2(SO4)3,该反应的化学方程式为_________。
(3)选用MgO调节pH使 Fe3+转化为沉淀,而不选用NaOH的原因是_____。加氧化镁调节后溶液的 pH范围是____ (用不等式表示)
(4)溶液C经加热浓缩、降温结晶、过滤、洗涤、低温干燥后得到 MgSO47H2O 晶体,低温干燥的目的是_____。
【题目】理科实验操作考试中,小明同学在做铝和稀盐酸反应时无意中加入硫酸铜溶液,发现铝片表面上产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计实验1)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10﹪稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
硫酸铜饱和溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)上述表格中V=__________。
(2)写出铝和稀盐酸反应的化学方程式__________。
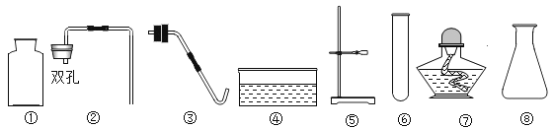
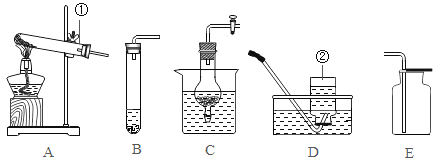
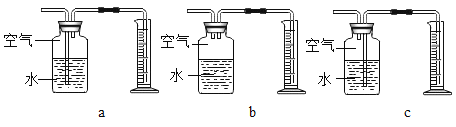
(3)定量收集氢气体积可用如图__________(填字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先快后慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜溶液体积的增加,反应速率明显变慢可能的原因是_______________。
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是______________。
(实验反思)加快铝和稀盐酸反应速率还可以采取的措施是(写一点)_____________。
(设计实验2)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10﹪稀盐酸混合后加入不同的盐溶液,实验现象如下(加号越多,代表反应速率越快)。
实验 | ① | ② | ③ | ④ | ⑤ |
加入试剂0.5mL | 水 | 5﹪NaCl溶液 | 5﹪Mg(NO3)2溶液 | 5﹪FeSO4溶液 | 5﹪CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)上表中,用水进行实验的目的是_______________。
(7)上述实验设计存在有缺陷,该缺陷是_____________。改进实验后,仍符合上表中的实验现象,可得到的实验结论是_________(写一点)。