题目内容
某科技活动小组利用氯酸钾和二氧化锰共热制取一定量的氧气.混合27.6g氯酸钾和2.0g二氧化锰加热制取一定量的氧气后,使反应停止,测得剩余固体中二氧化锰的质量分数为10.0%.请计算:(1)剩余固体的质量;
(2)制得氧气的质量;
(3)未分解的氯酸钾的质量.(计算结果保留一位小数)
【答案】分析:二氧化锰在该反应中作催化剂,反应前后质量不变.
(1)由二氧化锰的质量和剩余固体中二氧化锰的质量分数,可以计算出剩余固体的质量.
(2)根据质量守恒定律知:用原氯酸钾和二氧化锰的质量和去掉剩余固体的质量就是生成氧气的质量.
(3)由生成氧气的质量根据氯酸钾分解的化学方程式可以计算出分解的氯酸钾的质量,由原氯酸钾和分解的氯酸钾的质量可以计算出未分解的氯酸钾的质量.
解答:解:(1)剩余固体的质量为
2.0g÷10%=20.0g
(2)生成氧气的质量为
27.6g+2.0g-20.0g=9.6g
(3)设未分解的氯酸钾的质量为x.
2KClO3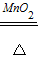 2KCl+3O2↑
2KCl+3O2↑
245 96
27.6g-x 9.6g
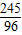 =
=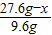 ,x=3.1g
,x=3.1g
答:(1)剩余固体的质量为20.0g;
(2)制得氧气的质量为9.6g;
(3)未分解的氯酸钾的质量为3.1g.
点评:本题主要考查质量守恒定律和有关化学方程式的计算,难度较大.注意:
(1)减少的质量为生成氧气的质量.
(2)剩余固体中含有二氧化锰、未分解的氯酸钾和生成的氯化钾.
(3)原氯酸钾包括未分解的氯酸钾和分解的氯酸钾.
(1)由二氧化锰的质量和剩余固体中二氧化锰的质量分数,可以计算出剩余固体的质量.
(2)根据质量守恒定律知:用原氯酸钾和二氧化锰的质量和去掉剩余固体的质量就是生成氧气的质量.
(3)由生成氧气的质量根据氯酸钾分解的化学方程式可以计算出分解的氯酸钾的质量,由原氯酸钾和分解的氯酸钾的质量可以计算出未分解的氯酸钾的质量.
解答:解:(1)剩余固体的质量为
2.0g÷10%=20.0g
(2)生成氧气的质量为
27.6g+2.0g-20.0g=9.6g
(3)设未分解的氯酸钾的质量为x.
2KClO3
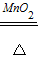 2KCl+3O2↑
2KCl+3O2↑245 96
27.6g-x 9.6g
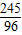 =
=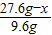 ,x=3.1g
,x=3.1g答:(1)剩余固体的质量为20.0g;
(2)制得氧气的质量为9.6g;
(3)未分解的氯酸钾的质量为3.1g.
点评:本题主要考查质量守恒定律和有关化学方程式的计算,难度较大.注意:
(1)减少的质量为生成氧气的质量.
(2)剩余固体中含有二氧化锰、未分解的氯酸钾和生成的氯化钾.
(3)原氯酸钾包括未分解的氯酸钾和分解的氯酸钾.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目