题目内容
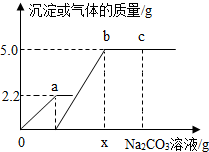 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )
向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )| A、c点溶液的pH>7 |
| B、b点溶液中溶质有2种 |
| C、图中0~a段表示生成沉淀的过程 |
| D、若x=106.0g则b处产生沉淀的质量为10g |
考点:盐的化学性质,溶液的酸碱性与pH值的关系,根据化学反应方程式的计算
专题:常见的盐 化学肥料
分析:加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了.
解答:解:A、c点的溶液中含有Na2CO3、NaCl两种溶质,由于Na2CO3显碱性,NaCl显中性,所以c的溶液的pH>7;故A选项正确;
B、b点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故B选项错误;
C、图中oa段表示生成的气体质量,故C选项错误;
D、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀10g.设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀10g所需Na2CO3的质量为z.则
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
y 2.2g
=
解得,y=5.3g;
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
z 10g
=
解得z=10.6g;
所以x=
=159g;
故D选项错误;
故选A.
B、b点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故B选项错误;
C、图中oa段表示生成的气体质量,故C选项错误;
D、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀10g.设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀10g所需Na2CO3的质量为z.则
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
y 2.2g
| 106 |
| y |
| 44 |
| 2.2g |
解得,y=5.3g;
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
z 10g
| 106 |
| z |
| 100 |
| 5.0g |
解得z=10.6g;
所以x=
| 5.3g+10.6g |
| 10% |
故D选项错误;
故选A.
点评:解答本题关键要知道只有把盐酸反应完了,才能与氯化钙反应产生沉淀,因为如果碳酸钠与氯化钙先反应生成了碳酸钙沉淀,也会被剩余的盐酸溶解掉,将不会看到沉淀.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
打开电视经常听到一句广告词“腰酸背痛脚抽筋--得补钙”.这里的“钙”应理解为( )
| A、分子 | B、原子 | C、原子 | D、元素 |
除去NaCl溶液中的少量Na2CO3,下列试剂中,不可用的是( )
| A、稀盐酸 |
| B、稀硫酸 |
| C、BaCl2溶液 |
| D、CaCl2溶液 |
决定元素种类的因素是( )
| A、质子数和中子数 |
| B、核外电子数 |
| C、质子数. |
| D、相对原子质量 |
下列各组中的物质完全反应后形成溶液的质量比反应前溶液的总质量大的是( )
| A、碳酸钠溶液和稀盐酸 |
| B、铜和硝酸银溶液 |
| C、二氧化碳和氢氧化钠溶液 |
| D、氢氧化钡溶液和氣化镁溶液 |
下列关于水的说法中正确的是( )
| A、水由两个氢元素和一个氧元素组成 |
| B、水由水分子构成 |
| C、水分子由两个氢原子和一个氧原子构成 |
| D、水分子由氢元素和氧元素构成 |
下列说法正确的是( )
| A、根据质量守恒定律,1L氢气和1L氧气反应生成2L水 |
| B、蜡烛完全燃烧后,蜡烛没有了,违背了质量守恒定律 |
| C、只有固体、液体间的反应才遵守质量守恒定律,如果有气体参加反应,就不遵守了 |
| D、铁丝在氧气中燃烧生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和 |
