题目内容
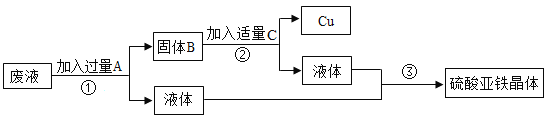
【题目】某工厂欲从只含有硫酸铜的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
请回答:
(1)流程①中加入过量A的目的是_____。写出加过量A时反应的化学方程式_____。
(2)流程②中为了回收到较纯的金属铜,加入的C物质是_____(填名称)。
(3)流程①和流程②中所得液体成分相同。判断流程②中加入“适量”C的方法_____。
(4)若该废液中含4t硫酸铜,理论上可从该废液中回收金属铜的质量多少t_____?
【答案】使硫酸铜全部反应 Fe+CuSO4=Cu+FeSO4 稀硫酸 加入最后一滴稀硫酸时,溶液中无气泡生成 1.6t
【解析】
(1)根据流程图可知,流程①得到的液体中含有硫酸亚铁。铁的金属性比铜强,可置换出硫酸铜中的铜,为使硫酸铜全部反应必须加过量的铁;加过量A时的反应是铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为: Fe+CuSO4=Cu+FeSO4;
(2)流程①得到的固体为铜和铁(过量),铁与硫酸反应生成硫酸亚铁和氢气,流程②中为了回收到较纯的金属铜,加入的C物质是稀硫酸;
(3)流程①中所得液体的成分是硫酸亚铁,若流程①和流程②中所得液体成分相同,则流程②中铁与稀硫酸恰好完全反应。判断流程②中加入“适量”C的方法:加入最后一滴稀硫酸时,溶液中无气泡生成;
(4)设可从该废液中回收金属铜的质量为x。
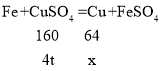
![]()
解得:x=1.6t。
答:理论上可从该废液中回收金属铜的质量为1.6t。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研究性学习小组的同学在老师的指导下对该产品开展了以下探究活动。
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为122),它是一种白色固体粉末,易溶于水且能与水反应生成一种产物碳酸钠(Na2CO3)和另一种强氧化性的物质,具有去污、杀菌的作用,也是当前使用最为广泛的洗涤剂助剂之一;过碳酸钠具有无毒,无臭,遇热易分解,与可燃物接触易起火等性质。
(实验探究)过碳酸钠的化学组成是什么?为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格中的空格内容:
序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) | |
① | 向盛有过碳酸钠固体的试管中加入适量的水 | 固体溶解 | _____。 | |
② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡产生 | ||
③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是_____;过碳酸钠溶于水能生成_____(填化学式)。 | |
实验 小结 | 过碳酸钠的化学式是_____;过碳酸钠与水反应的化学方程式是_____。 | |||
(反思拓展)(1)根据过碳酸钠的化学性质,过碳酸钠可作为医院、公共场所的_____;
(2)洗涤产品“污渍爆炸盐”的保存方法是:_____。