题目内容
【题目】过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法. 已知:温度过高过氧化物会分解生成氧化物和氧气.
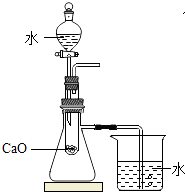
方法1:由Ca(OH)2为原料最终反应制得,其制备流程如图1: 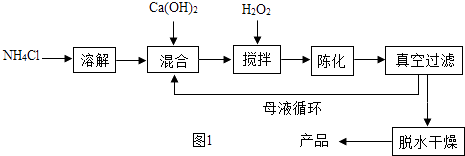
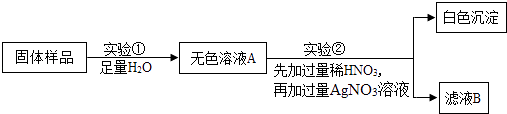
方法2:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如图2:
(1)方法1中搅拌的目的是 . 请将搅拌过程中发生反应的化学方程式补充完整:CaC12+H2O2+2NH3H2O+6═CaO28H2O↓+2NH4Cl.制备过程中除水外可循环使用的物质是(填化学式).
(2)方法2中气体X是 , 实验室常用溶液来吸收.煅烧后的反应是化合反应,也能生成CaO28H2O,反应的化学方程式为 . 该反应需控制温度在0~2℃,可将反应器放置在 , 获得的CaO2产品中主要含有的固体杂质是(填化学式).
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高会造成氨水挥发外,还能 .
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是(填“方法1”或“方法2”).
【答案】
(1)使反应充分,提高原料利用率;H2O;NH4C1
(2)CO2;NaOH;Ca(OH)2+H2O2+6H2O=CaO2?8H2O;冰水中;Ca(OH)2
(3)使CaO2分解
(4)方法1
【解析】解:(1)搅拌可以使药品均匀混合,所以方法1中搅拌的目的是:使反应充分,提高原料利用率;依据质量守恒定律可知,化学反应前后原子个数不变,所以需要补充的物质是水,氯化铵既出现在了反应物中,也出现在了生成物中,所以制备过程中除水外可循环使用的物质是:NH4C1;(2)鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以X是二氧化碳,在实验室常用氢氧化钠来吸收二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙和双氧水反应生成过氧化钙晶体,化学方程式为:Ca(OH)2+H2O2+6H2O=CaO28H2O,冰水混合物的温度是0℃,所以反应需控制温度在0~2℃,可将反应器放置在冰水中,氢氧化钙是反应物,但是在反应过程中不一定会完全反应,所以获得的CaO2产品中主要含有的固体杂质是Ca(OH)2;(3)依据题中的知识可知,温度过高过氧化物会分解生成氧化物和氧气,所以温度过高会造成氨水挥发外,还能使CaO2分解;(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,方法1中没有副产物,方法2中有副产物二氧化碳,所以上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是:方法1. 所以答案是:(1)使反应充分,提高原料利用率;H2O,NH4C1;(2)CO2 , NaOH,Ca(OH)2+H2O2+6H2O=CaO28H2O,冰水中,Ca(OH)2;(3)使CaO2分解;(4)方法1.
【考点精析】解答此题的关键在于理解绿色化学的相关知识,掌握绿色化学-----环境友好化学(化合反应符合绿色化学反应)①四特点P6(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染,以及对质量守恒定律及其应用的理解,了解①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

 期末集结号系列答案
期末集结号系列答案【题目】小瑾同学用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁,下列关系错误的是( )
甲 | 乙 | 丙 | 丁 | |
A | 碱 | 烧碱 | 氢氧化钾 | 纯碱 |
B | 合成材料 | 塑料 | 合成纤维 | 合成橡胶 |
C | 溶液 | 糖水 | 生理盐水 | 泥浆 |
D | 化石燃料 | 石油 | 煤 | 酒精 |

A.A
B.B
C.C
D.D